文章编号:1004-0609(2011)08-1921-08
电解液中甲酰胺浓度对阳极氧化制备TiO2纳米管阵列形貌和光催化性能的影响
马 清1,刘绍军1, 2,翁履谦1,董文艺3
(1. 哈尔滨工业大学 深圳研究生院,材料科学与工程学科部,深圳 518055;
2. 中南大学 粉末冶金国家重点实验室,长沙 410083;
3. 哈尔滨工业大学 深圳研究生院 城市与土木工程学科部,深圳 518055)
摘 要:
分别以0.5%HF水溶液(A)、0.3 mol/L NH4F+70% H2O+30%甲酰胺(体积分数)(B)、0.3 mol/L NH4F+30% H2O+70%甲酰胺(体积分数)(C)和0.3 mol/L NH4F+3% H2O+97%甲酰胺溶液电解液(体积分数)(D)作为电解液,对比研究甲酰胺含量对电化学阳极氧化TiO2纳米管阵列的形貌、结构和光催化性能的影响。结果表明: TiO2纳米管阵列长度随甲酰胺含量的增加而增加;水基电解液A中制备的纳米管长度、壁厚和管径分别约为600、20和100 nm,且分布不均匀;甲酰胺基电解液D中制备的纳米管长度、壁厚和管径分别约为10 μm、5 nm和60 nm,且管径分布均匀;样品在O2中经450 ℃退火2 h后,发现甲酰胺基电解液A中制备的TiO2纳米管为单相锐钛矿结构,其它样品则为复合锐钛矿相和金红石相结构。光催化降解甲基橙的结果表明:随着TiO2纳米管阵列的厚度增加及管壁减小,紫外光光催化效率明显提高。
关键词:
中图分类号:TQ153.6;TB34 文献标志码:A
Effect of formamide in electrolyte on morphology and photocatalytic activity of TiO2 nanotube arrays by anodization
MA Qing1, LIU Shao-jun1, 2, WENG Lü-qian1, DONG Wen-yi3
(1. Division of Materials Science and Engineering, Shenzhen Graduate School, Harbin Institute of Technology, Shenzhen 518055, China;
2. State Key Laboratory for Powder Metallurgy, Central South University, Changsha 410083, China;
3. Division of Urban and Civil Engineering, Shenzhen Graduate School, Harbin Institute of Technology, Shenzhen 518055, China)
Abstract: The influence of the fomamide concentration in the electrolytes on the morphology and structure was investigated in the electrolytes of 0.5%HF water solution (A), 0.3 mol/L NH4F+70%H2O+30% formamide (volume fraction) (B), 0.3% mol/L NH4F+30%H2O+70% formamide (volume fraction) (C) and 0.3 mol/L NH4F+3%H2O+97% formamide (volume fraction) (D). The nanotube becomes long and its wall thickness becomes smaller with increasing formamide concentration in electrolyte. The results show that the nanotube becomes longer and its wall thickness becomes smaller with increasing formamide concentration in electrolyte. The tube length, pore diameter and wall thickness of TiO2 nanotube arrays anodized in water-based electrolyte A are about 600 nm, 100 nm and 5 nm, respectively. The tube length, wall thickness and pore diameter for sample anodized in formamide-based electrolyte D are about 10 μm, 5 nm and 60 nm, respectively. After being annealed at 450 ℃ for 2 h in oxygen, the single anatase structure is obtained for sample anodized in electrolyte A. In contrast, the mixed anatase and rutile phase are observed in TiO2 nanotube for the other three samples. The results of photodegradation of methyl orange (MO) show that TiO2 nanotubes with longer tube length and thinner wall thickness have higher photocatalytic activity.
Key words: electrochemical anodization; electrolyte; TiO2 annotube; photocatalytic
具有纳米结构的二氧化钛(TiO2)由于其优异的物理和化学性能以及良好的机械和化学稳定性[1]而在太阳能电池[2]、光催化剂[3]、气敏原件[4]以及生物材料[5]等领域有广泛的应用前景。在纳米管、纳米薄膜和纳米粉体等作为废水有机物降解的纳米结构TiO2光催化剂中,纳米粉体存在着回收复杂及难于重复性使用等问题。电化学阳极氧化法制备的TiO2纳米管阵列不仅具有良好的机械强度[6],而且具有更高的比表面积和更好的光催化活性[7],因而得到了更多的关注。
除了电解时间和电压,电化学阳极氧化中的电解液组成是影响TiO2纳米管形貌与结构以及性能的重要因素[8]。氢氟酸是最先用于阳极氧化制备TiO2纳米管阵列的水性电解液[9],但制备的TiO2纳米管长度较短,仅为约500 nm且开口端圆形度较差。PAULOSE等[10]使用甲酰胺基电解液等在内的非水性有机电解液制备出长度超过134 μm的超长纳米管阵列。除了电子结构和晶体结构等因素外,由于影响着载流子的吸收与传播,TiO2纳米管的长度、管径以及壁厚等形貌因素也对光催化性能产生重要的影响。LAI等[1]讨论在HF酸电解液中阳极氧化制备的TiO2纳米管长度及其结晶度对紫外光吸收性能的影响,但没有提及纳米管壁厚对光催化性能的影响。LIU等[11]使用0.5% HF和甲酰胺基的电解液阳极氧化制备了长度为0.21 μm、12 μm和17 μm的TiO2纳米管阵列,其中17 μm长度的TiO2纳米管阵列显示更好的光催化降解苯酚效果。然而,LIANG等[12]报道TiO2纳米管的壁厚比纳米管的长度对光催化活性有更为显著的影响,其中约28 nm壁厚的纳米管在30 min光照后就获得约为93%的2, 3-二氯苯酚降解效果。
为了探讨纳米管的长度和壁厚等形貌因素对相转变以及光催化性能的影响,本文作者对比讨论不同配比的水基与甲酰胺基电解液对电化学阳极氧化法制备的TiO2纳米管阵列的长度、管径以及壁厚等表面形貌与结构的影响。并在此基础上,研究TiO2纳米管阵列的形貌与结构变化对光催化降解甲基橙(Methyl orange, MO)催化活性的影响。
1 实验
实验用纯钛箔购于Sigma-Aldrich(纯度99.7%,厚度0.25 mm),实验前分别用丙酮、乙醇和蒸馏水超声清洗后在烘箱中干燥。采用0.5%HF酸的水性基电解液,电化学阳极氧化法制备TiO2纳米管阵列在室温 (25 ℃)和20 V恒电压下进行,阳极氧化时间为1 h。随后,TiO2纳米管阵列前驱体在马弗炉中以2 ℃/min的升温速率升温至450 ℃并保温2 h,试样随炉冷却,退火气氛为纯氧气。
TiO2纳米管试样的光催化性能通过紫外光催化降解甲基橙(MO)测试,MO初始浓度c0为20 mg/L。所用光源为Philip 460 W高压汞灯,其特征波长为365 nm,光源距离TiO2纳米管试样10 cm。光催化降解MO反应在自制的带循环冷却水系统的石英容器中进行。降解前后的甲基橙吸收值则通过上海菁华723型可见分光光度计测定。在30、60、120和240 min后取样测量降解后的MO在463 nm波长的吸收值。
采用Hitachi S-4700场发射扫描电子显微镜(FESEM)与JEM-2010(HR)透射电子显微镜(HRTEM)对纳米管阵列形貌进行表征。采用理学Rigaku高分辨XRD和Renishaw Invia Micro-Raman Spectroscopy System拉曼光谱仪对试样晶体结构进行表征。采用日本岛津Shimadzu UV-2450紫外-可见分光光度计对TiO2纳米管阵列进行紫外-可见漫反射吸收光谱(UV-vis-diffuse reflection spectra, DRS)测定。
2 结果与讨论
图1所示为在不同电解液中制备的未经退火处理TiO2纳米管阵列的SEM像。表1所列为不同电解液阳极氧化制备的TiO2纳米管阵列形貌参数和结构参数数据。由图1(a)和(b)可以看出,水基电解液A中制备的TiO2纳米管管径约为50~100 nm,管壁厚度约为15~20 nm,但纳米管开口端圆形度较差。由于相邻纳米管壁之间的溶解和侵蚀,存在着很大程度的小直径纳米管合并生长为大直径纳米管的情况。因此,纳米管管径分布不均匀,但纳米管底部排列紧密。纳米管长度约为600 nm且部分管壁存在着开口破裂现象(见图1(b))。相比较,随着电解液中有机甲酰胺含量的增加,纳米管长度明显增加,管径与壁厚都呈减小趋势。当电解液D中甲酰胺含量达到了97%时,TiO2纳米管管径约为60 nm且开口端多为圆形管状,管壁厚度约为5~10 nm且管径分布均匀(见图1(g))。图1(h)所示为在电解液D中阳极氧化得到的TiO2纳米管阵列的底部和侧面形貌图,可以看出TiO2纳米管的长度明显增大,长度超过了10 μm(见图1(h))。同时,可以观察到TiO2纳米管之间存在一定的间隙且分布均匀,这表明在高浓度甲酰胺的电解液中能生长相对独立的纳米管。作为一种比较温和的电解液[13],甲酰胺基电解液中的甲酰胺的电阻率比水的大得多。另一方面,甲酰胺电解液中所能提供的氧源也比水基电解液中要少得多[14]。这些都在一定程度上抑制阳极氧化反应过程中由F-反应引起的化学溶解速率,从而使得刻蚀速率较慢并有利于更长TiO2纳米管的形成。因而,通过阳极氧化能够在高浓度甲酰胺的电解液中制备出比低浓度甲酰胺电解液更长的TiO2纳米管。图2所示为在O2气氛经450 ℃下退火2 h后的TiO2纳米管阵列的SEM像。由图2可见,退火后的TiO2纳米管阵列结构保持稳定, 没有发生显著的变化。

图1 不同甲酰胺浓度电解液制备的TiO2纳米管阵列的SEM像
Fig.1 SEM images and cross-section images of as-anodized TiO2 nanotube arrays in electrolytes with different formamide contents
为了进一步确认纳米管在形貌上的细微差别,对在电解液A和D中制备的纳米管分别进行HRTEM表征。图3所示为在电解液A和D中制备样品在氧气气氛和450 ℃退火2 h后的HRTEM像。由图3可见,在电解液A中制备的样品经退火后,其平均壁厚约为15~20 nm,但管壁厚度不均匀,管径约为90~100 nm。在电解液D中制备的样品,其纳米管壁要明显均匀且管壁平滑,平均壁厚约为5~10 nm,管径约为55~60 nm。这些结果与表1中的形貌参数基本一致。

图2 在O2气氛下经450 ℃退火2 h后TiO2纳米管阵列的SEM像
Fig.2 SEM images of TiO2 nanotube arrays annealed at 450 ℃ for 2 h in oxygen
表1 电解液中甲酰胺浓度对TiO2纳米管阵列形貌和结构的影响
Table 1 Effect of formamide content in electrolyte on morphologies and structures of TiO2 nanotube arrays

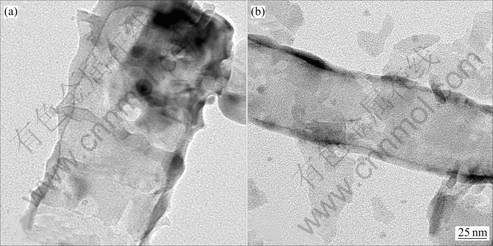
图3 试样在O2气氛经450 ℃下退火2 h后TiO2纳米管的HRTEM像
Fig.3 HRTEM images of TiO2 nanotube anodized in different electrolytes after annealed at 450 ℃ for 2 h in oxygen: (a) Electrolyte A; (b) Electrolyte D
图4所示为TiO2纳米管阵列在O2气氛经450 ℃退火2 h后的XRD谱。2θ角为25°与48°附近的衍射峰对应着锐钛矿相的特征衍射峰,而2θ角为27°附近的衍射峰则对应着金红石相的特征衍射峰,其余为Ti基板的特征衍射峰。从图4可见,随着TiO2纳米管长度的增加,锐钛矿相的(101)衍射峰强度明显增强。在甲酰胺基电解液D中制备的样品的衍射峰强度要明显高于在A、B和C电解液中制备的样品的衍射峰强度。相比于在水基电解液中的阳极氧化,在甲酰胺电解液阳极氧化时的TiO2纳米管壁的化学侵蚀会逐渐减轻,TiO2纳米管的生长变得更加稳定,因此,制备出的 TiO2纳米管长度远大于前者并使得试样中锐钛矿相的含量更多。类似的结果在TiO2薄膜也曾报道过[15]。在水基电解液A、B、C中制备的TiO2纳米管经450 ℃退火后存在一部分金红石相,而在甲酰胺基电解液D中制备的TiO2纳米管在450 ℃退火后则没有金红石相的生成。纳米管试样中的金红石与锐钛矿相相对质量分数可由式(1)[16]获得:
![]() (1)
(1)
式中:Ia和Ir分别为锐钛矿(101)和金红石(110)衍射峰积分强度;K取0.79。
由式(1)可以计算出电解液A、B、C、D中制备的样品中金红石相的含量分别为54.3%、1.7%、1.9%和0。这些差别与TiO2纳米管壁厚存在着密切的关系。VARGHESE等[17]报道在平均壁厚约为(27±6) nm的纳米管阵列中,由于受到纳米管壁厚尺寸的限制,在纳米管壁上没有金红石相成核而只在纳米管底部与基板的接触面上有金红石相生成。然而,为了澄清管壁厚与锐钛矿相和金红石相之间的相转变动力学关系,有必要进行进一步的实验。
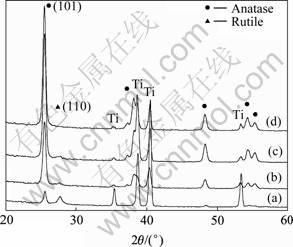
图4 在O2气氛经450 ℃退火2 h后TiO2纳米管阵列XRD谱
Fig.4 XRD patterns of TiO2 nanotube arrays anodized in electrolyte with different formide concentrations and annealed at 450 ℃ for 2 h in oxygen: (a) Electrolyte A; (b) Electrolyte B; (c) Electrolyte C; (d) Electrolyte D
相比于XRD谱,Raman光谱是对锐钛矿相和金红石相更为敏感的材料表征手段。图5所示为在O2气氛经450 ℃退火2 h后的TiO2纳米管阵列Raman谱。对于锐钛矿型结构TiO2,其对应的Raman振动峰分别为147 cm-1 (Eg)、198 cm-1 (Eg)、398 cm-1 (B1g)、515 cm-1 (A1g+B1g)和640 cm-1 (Eg)[18]。如图5所示,在甲酰胺基电解液D中制备的TiO2纳米管位于146、199、395、517和638 cm-1处的Raman振动峰均对应于锐钛矿相,而没有金红石相振动峰的出现。在水基电解液A中制备的TiO2纳米管试样在444 cm-1处存在一个微弱的对应着金红石相的Eg(440 cm-1)振动峰,这表明试样中存在着少量的金红石相,并与XRD的结果相一致。此外,相比于在甲酰胺基电解液D中制备的样品中锐钛矿的振动峰,在水基电解液A中制备的样品中锐钛矿相振动峰存在一定程度的蓝移。这种峰位的移动一方面是由于量子尺寸效应引起的,另一方面也是锐钛矿向金红石转变的结果[19]。此外,在甲酰胺基电解液D中制备的样品在146 cm-1处的锐钛矿相特征振动峰发生了细微的宽化。这可能是由于晶体粒径的变小导致其表面积和表面原子数目的增加,而表面原子由于缺少相邻原子而处于相对松弛状态并使得相应的振动频率变低所引起的[20]。
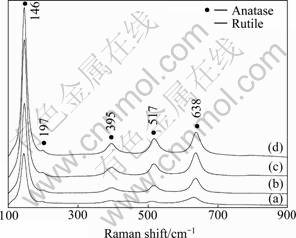
图5 在O2气氛经450 ℃退火2 h后TiO2纳米管阵 Raman谱
Fig.5 Raman spectra of TiO2 nanotube arrays anodized in electrolyte with different formide concentrations and annealed at 450 ℃ for 2 h in oxygen: (a) Electrolyte A; (b) Electrolyte B; (c) Electrolyte C; (d) Electrolyte D
图6所示为TiO2纳米管阵列在450 ℃于O2中退火2 h后的UV-vis-DRS谱。由图6可见,不同长度与管壁的纳米管阵列的UV-vis吸收曲线具有明显不同的差别。通常TiO2纳米管阵列的吸收带边可由直线外推法得到[21]。由此获得的在电解液A、B、C、D中制备的样品经450 ℃退火后的吸收带边分别为389、404、415和425 nm。由于吸收带边的红移受到相组成与形貌的影响,相组成将直接影响到TiO2纳米管阵列的吸收带边位置。而TiO2纳米管形貌也会对吸收带边的移动产生一定的影响。ZHUANG等[22]发现2.5 μm长度的TiO2纳米管较0.4 μm长度的TiO2纳米管的吸收带边红移了40~50 nm。由图6还可以看出,甲酰胺基电解液D中制备的样品在波长小于500 nm区域内具有更强的吸收,这主要是由于甲酰胺基电解液中制备的样品具有更长的纳米管长度,使得其内部表面积和单位体积能够捕获的载流子数目的增加[22],因而,其Uv-vis吸收更强。LAI等[1]报道了在430 nm甚至更小波长范围的UV-vis吸收主要是由于捕获空穴所引起的。相比较,由于在甲酰胺基电解液D中制备的样品壁厚明显降低,其表面态急剧增加而降低了非辐射引起的表面电子与空位的复合,这导致所能捕获载流子数目的增加。
通常,TiO2纳米管试样在450 ℃于O2中退火2 h后的紫外光催化降解MO动力学拟合曲线由公式(2)[23]得到,其结果如图7所示:
![]() (2)
(2)
式中:c0与c分别为MO的初始浓度和催化反应后的浓度;A0与At则分别为初始和t时间光照后MO在463nm的吸收值。如图7所示,空白样品(Blank)为无TiO2纳米管试样的紫外光催化降解甲基橙拟合曲线,k=2.15×10-4 min-1。通过拟合电解液A、B、C、D中制备的TiO2纳米管试样紫外光催化降解MO曲线,其k值分别为(4.03±0.209)×10-4 min-1、(6.28±0.208)× 10-4 min-1、(8.68±0.708)×10-4 min-1、(5.06±0.528)× 10-3 min-1。明显地,电解液D中制备的样品的k值远大于电解液A、B、C中制备的样品的k值,这表明其紫外光催化降解MO效果要明显优于其它3种试样的。已有研究表明[1, 11, 24],紫外光催化降解率的高低主要受TiO2纳米管阵列表面形貌和相结构的影响。一方面,TiO2纳米管的表面积会随着其长度的增加而增加,相应地,也增加了TiO2光催化剂与MO的接触面积而有利于光催化性能的提高;另一方面,甲酰胺基电解液D中制备的TiO2纳米管壁厚仅为5~10 nm,远小于电解液A、B、C中所制备样品的壁厚(约20 nm)。纳米管壁厚的增加会阻碍载流子的高效迁移[24],并降低光催化化活性。壁厚的减小使得TiO2纳米管表面态迅速增加,有利于激发电子从试样内部迁移到表面并提高了TiO2纳米管的光催化性能[12]。

图6 在O2气氛中经450 ℃退火2 h后TiO2纳米管阵列UV-vis-DRS曲线
Fig.6 UV-vis-DRS curves of TiO2 nanotube arrays anodized in electrolyte with different formide concentrations and annealed at 450 ℃ for 2 h in oxygen: (a) Electrolyte A; (b) Electrolyte B; (c) Electrolyte C; (d) Electrolyte D

图7 TiO2纳米管阵列紫外光催化降解MO动力学拟合曲线
Fig.7 Kinetic curves of MO degradation of TiO2 nanotube arrays annealed in oxygen for 2 h: (a) Electrolyte A; (b) Electrolyte B; (c) Electrolyte C; (d) Electrolyte D
由于在不同电解液中制备的TiO2纳米管阵列的长度不同,本研究对其光催化活性进行了长度的归一化处理,即将k值除以TiO2纳米管长度。归一化处 理后的样品k值分别为(6.72±0.384)×10-4、 (6.78±0.384)×10-4、(2.48±0.202)×10-4和(5.06± 0.0384)×10-4 min-1/μm。尽管电解液A中制备的TiO2纳米管阵列长度约为0.60 μm,而电解液D中制备的TiO2纳米管阵列长度则大于10 μm,其长度为电解液A中制备试样的16倍多。此外,电解液D中制备的纳米管壁厚(5~10 nm)也远低于电解液A中制备的纳米管壁厚(约20 nm)。但其紫外光催化降解甲基橙动力学k值仅为电解液A中制备试样的约12倍。其紫外光催化效果没有随TiO2纳米管长度呈正比增加的原因可能有两方面:一方面,退火后电解液A中制备的试样为复合锐钛矿和金红石相结构。OHNNO等[25]和KAWAHARA等[26]的研究表明,具有一定比例的复合锐钛矿和金红石相结构中,由于两相之间的费米能级差异使得两相界面处能够作为电子陷阱的存在而有利于光生电子的捕获,其紫外光催化效果要优于单相锐钛矿或金红石相的。因此,复合锐钛矿相和金红石相的存在在一定程度上弥补了电解液A中制备的试样在纳米管长度上对紫外光催化效果的不利影响。另一方面,这也与有效参与光催化反应的纳米管长度有关,当纳米管长度超过一定范围时反而不利于光催化性能的提高。如果纳米管长度超过紫外光的有效穿透深 度[22],纳米管所能吸收到的入射光子将不会因为纳米管长度的增加而有所增加。此外,由于甲基橙分子不仅存在于纳米管的外壁,而且由于毛细管作用还会渗透到纳米管的内壁,而内壁所能渗透的甲基橙分子数目通常不会随着纳米管长度的增加而增多[12]。
3 结论
1) 随着电解液中甲酰胺浓度的增加,水对TiO2纳米管的溶解和侵蚀程度降低,这导致TiO2纳米管长度的增加以及开口端圆形度的增加。
2) 纳米管壁厚对TiO2相转变有重要影响,样品经450 ℃氧气中退火2 h后,甲酰胺基电解液D中阳极氧化的TiO2纳米管(壁厚为5~10 nm)为单相锐钛矿结构,其它样品(壁厚约20 nm)则为复合锐钛矿相和金红石相结构。
3) TiO2纳米管阵列的紫外光催化效果不会随TiO2纳米管阵列的长度而呈正比增加。当TiO2纳米管阵列的长度超过一定范围时,反而不利于光催化活性的提高。电解液D中制备的样品的紫外光催化降解MO效果要明显优于其它3种样品的。然而,水基电解液A中制备的纳米管试样具有相对较高的单位长度紫外光催化降解甲基橙降活性解率。
REFERENCES
[1] LAI Yue-kun, SUN Lan, CHEN Yi-cong, ZHUANG Hui-fang, LIN Chang-jian, CHIN J W. Effect of the structure of TiO2 nanotube array on Ti substrate on its photocatalytic activity[J]. J Electrochem Soc, 2006, 153(7): 123-127.
[2] O’REGAN B, GRATZEL M. A low-cost, high-efficiency solar cell based on dye-sensitized colloidal TiO2 films[J]. Nature (London), 1991, 353: 737-739.
[3] ASAHI R, MORIKAWA T, OHWAKI T, AOKI K, TAGA Y. Visible-light photocatalysis in nitrogen-doped titanium oxides[J]. Science, 2001, 293: 269-271.
[4] GRIMES C A. Synthesis and application of highly ordered arrays of TiO2 nanotubes[J]. J Mater Chem, 2007, 17: 1451-1457.
[5] YANG Bang-cheng, UCHIDA M, KIM H M, ZHANG Xing-dong, KOKUBO T. Preparation of bioactive titanium metal via anodic oxidation treatment[J]. Biomater, 2004, 25(6): 1003-1010.
[6] TSUCHIYA H, MACAK J M, TAVEIRA L, BALAUR E, GHICOV E, SIROTNA K, SCHMUKI P. Self-organized TiO2 nanotubes prepared in ammonium fluoride containing acetic acid electrolytes[J]. Electrochem Commun, 2005, 7(6): 576-580.
[7] ALBU S P, GHICOV A, MACAK J M, HAHN R, SCHMUKI P. Self-organized, free-standing TiO2 nanotube membrane for flow-through photocatalytic applications[J]. Nano Lett, 2007, 7(5): 1286-1289.
[8] RUAN C, PAULOSE M, VARGHESE O K, MOR G K, GRIMES C A. Fabrication of highly ordered TiO2 nanotube arrays using an organic electrolyte[J]. J Phys Chem B, 2005, 109: 15754-15759.
[9] MOR G K, VARGHESE O K, PAULOSE M, GRIMES C A. Transparent highly ordered TiO2 nanotube arrays via anodization of titanium thin films[J]. Adv Funct Mater, 2005, 15(8): 1291-1296.
[10] PAULOSE M, SHANKAR K, YORIYA S, PRAKASAM H E, VARGHESE O K, MOR G K, LATEMPA T A, FITZGERALD A, GRIMES C A. Anodic growth of highly ordered TiO2 nanotube arrays to 134 μm in length[J]. J Phys Chem B, 2006, 110: 16179-16184.
[11] LIU Zhao-yue, ZHANG Xin-tong, NISHIMOTO S, JIN Ming, TRYK D A, MURAKAMI T, FUJISHIMA A. Highly ordered TiO2 nanotube arrays with controllable length for photoelectrocatalytic degradation of phenol[J]. J Phys Chem C, 2008, 112(1): 253-259.
[12] LIANG Hai-chao, LI Xiang-zhong. Effects of structure of anodic TiO2 nanotube arrays on photocatalytic activity for the degradation of 2,3-dichlorophenol in aqueous solution[J]. J Hazard Mater, 2009,162: 1415-1422.
[13] 张毓芳, 张正国, 方晓明. TiO2一维纳米材料及其纳米结构的合成[J]. 化学进展, 2007, 19(4): 494-501.
ZHANG Yu-fang, ZHANG Zheng-guo, FANG Xiao-ming. Synthesis of one-dimensional TiO2 nanomaterials and their nanostructures[J]. Progress in Chemistry, 2007, 19(4): 494-501.
[14] CHRISTOPHERSEN M, CARSTENSEN J, VOIGT K, FOLL H. Organic and aqueous electrolytes used for etching macro- and mesoporous silicon[J]. Phys Status Solidi A, 2003, 197(1): 34-38.
[15] SHANG Jing, LI Wei, ZHU Yong-fa. Structure and photocatalytic characteristics of TiO2 film photocatalyst coated on stainless steel webnet[J]. J Molecula Catalysis A: Chemical, 2003, 202: 187-195.
[16] SPURR R A, MYERS H. Quantitative analysis of anatase-rutile mixtures with an X-ray diffractometer[J]. Anal Chem, 1957, 29: 760-762.
[17] VARGHESE O K, GONG Da-wei, PAULOSE M, GRIMES C A. Crystallization and high-temperature structural stability of titanium oxide nanotube arrays[J]. J Mater Res 2003, 18(1): 156-165.
[18] SWAMY V, KUZNETSOV A, DUBROVINSKY L S, CARUSO R A, SHCHUKIN D G, MUDDLE B C. Finite-size and pressure effects on the Raman spectrum of nanocrystalline anatase TiO2[J]. Physical Review B, 2005, 71: 184302.
[19] 余锡宾, 王桂华, 罗衍庆, 李和兴. TiO2超微粒子的量子尺寸效应与光吸收特性[J]. 催化学报, 1999, 20(6): 613-618.
YU Xi-bin, WANG Gui-hua, LUO Yan-qing, LI He-xing. The quantum size effect and light absorption of ultrafine titania particles[J]. Chinese Journal of Catalysis, 1999, 20(6): 613-618.
[20] XU Jian-feng, CHENG Guang-xu, YANG Wei, DU You-wei. Raman scattering from surface phonons in fine Zn particles coated with ZnO[J]. J Phys B, 1996, 29(24): 6227-6232.
[21] RETUERT J, OUIJADA R, AREAS V. Porous titania obtained through polymer incorporated composites[J]. J Chem Mater, 1998, 10: 3929-3932.
[22] ZHUANG Hui-fang, LIN Chang-jian, LAI Yue-kun, SUN Lan, LI Jing. Some critical structure factors of titanium oxide nanotube array in its photocatalytic activity[J]. Environ Sci Technol, 2007, 41: 4735-4740.
[23] CHEN Ding-wang, RAY A K. Photodegradation kinetics of 4-nitrophenol in TiO2 suspension[J]. Wat Res, 1998, 32(11): 3223-3234.
[24] SREEKANTAN S, HAZAN R, LOCKMAN Z. Photoactivity of anatase-rutile TiO2 nanotubes formed by anodization method[J]. Thin Solid Films, 2009, 518: 16-21.
[25] OHNNO T, SARUKAWA K, TOKIEDA K, MATSUMURA M. Morphology of a TiO2 photocatalyst (Degussa, P-25) consisting of anatase and rutile crystalline phases[J]. J Catal, 2001, 203: 82-86.
[26] KAWAHARA T, KONISHI Y, TADA H, TOHGE N, NISHII J, ITO S. A patterned TiO2(anatase)/TiO2(rutile) bilayer-type photocatalyst: Effect of the anatase/rutile junction on the photocatalytic activity[J]. Angew Chem Int Ed, 2002, 41: 2811-2813.
(编辑 李艳红)
基金项目:国家“十一五”科技支撑计划资助项目(2009ZX07423-04);财政部水专项课题(2008ZX07317-02);深圳市基础研究计划项目(JC200903120193A);中南大学粉末冶金国家重点实验开放基金资助项目
收稿日期:2010-07-19;修订日期:2010-10-28
通信作者:刘绍军,副教授,博士;电话:0755-26032046;E-mail: shaojunliu@gmail.com


