文章编号:1004-0609(2011)06-1473-07
低品位硫化铜矿的细菌浸出
赖绍师,覃文庆,杨聪仁,王 军,张雁生,张 博,常自勇,匡浩华
(中南大学 资源加工与生物工程学院,长沙 410083)
摘要:以宁夏某低品位硫化铜矿为研究对象,利用嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans)和嗜酸氧化硫硫杆菌(Acidithiobacillus thiooxidans)的混合菌,采用摇瓶浸出、小型柱浸和大型柱浸对矿石可浸性进行研究;采用X射线衍射仪分析矿物及其浸渣的成分;采用扫描电镜分析浸渣表面形貌及其表面元素的含量。结果表明:摇瓶矿浆浓度为5%,浸出55 d铜浸出率为94.38%;小型柱浸处理矿石2.10 kg,矿石粒度小于15 mm,浸出226 d铜浸出率为62.50%;大型柱浸处理矿石77.85 kg,矿石粒度小于25 mm,浸出285 d铜浸出率为50.63%。柱浸过程中,铜的浸出速率逐渐下降;浸渣中钙含量基本不变,而元素硫的含量明显增加,且存在新的石膏相;浸出后矿石表面元素硫、钙、铁的含量明显增加,在浸出过程中生成的硫酸钙结晶覆盖在矿石表面,铁在矿石表面形成沉淀,使矿石的渗透性变差,导致铜的浸出率逐渐下降。
关键词:
中图分类号:TD982 文献标志码:A
Bioleaching of low grade copper sulfide ore
LAI Shao-shi, QIN Wen-qing, YANG Cong-ren, WANG Jun, ZHANG Yan-sheng, ZHANG Bo,
CHANG Zi-yong, KUANG Hao-hua
(School of Resource Processing and Bioengineering, Central South University, Changsha 410083, China)
Abstract: A mixed culture consisting of Acidithiobacillus ferrooxidans and Acidithiobacillus thiooxidans was used to study technical feasibility of bioleaching of some copper sulfide ore from Ningxia. The bioleaching test was carried out in flask, small-scale column and large-scale column. The residues were analyzed by chemical analysis and X-ray diffractometry. The residues surface and element content were analyzed by scanning electron microscopy and energy spectrum. The results show that 94.38% copper is extracted after 55 d in flask with a pulp density of 5%. 62.50% copper is extracted after 226 d in small-scale column with 2.10 kg ore, and the ore particle size is lower than 15 mm. 43.03% copper is extracted after 285 d in large-scale column with 77.85 kg ore, and the ore particle size is less than 25 mm. The copper leaching rate decreases gradually in later process, which is related with calcium sulphate and iron precipitation. In the residues calcium content is essentially the same, but the sulfur content evidently increases and gypsum is found, calcium and iron on the surface evidently increase, calcium sulphate crystallizes and iron precipitates on the ore surface, which worsen the penetrability of the ore and result in gradually dropping of copper leaching rate.
Key words: copper sulfide; calcium sulphate; bacterial leaching; iron precipitation
铜是国民经济建设的支柱性原材料,随着国民经济的飞速发展,对铜的需求量也不断加大,而随着铜矿的不断开采,矿石铜品位不断下降[1],近年来,富矿和易处理矿资源日益减少,加之近年来环保要求不断提高,对低品位和难处理铜矿处理方法的研究要求日趋深入。微生物浸出技术[2-3]具有投资少、成本低、效益高、污染低等优点且能够处理用传统选冶工艺不能经济回收的铜资源,因而是处理低品位铜矿资源很有前途的技术之一。
微生物浸出技术的缺点是浸出周期长、浸出速率慢,因为矿石浸出一段时间后浸出速率出现明显下降的现象——“钝化现象”。多年来,生物湿法冶金工作者围绕钝化现象进行了广泛而深入的研究。尽管大多数研究者均认为浸出过程中铜矿表面形成了阻碍层,从而导致浸出速率下降, 但对于阻碍层的形成机制和阻碍层的化学组成仍存在较大分歧。BHARATHI等[4]、SANDSTROM等[5]和THIRD等[6]研究认为,黄钾铁矾是浸出速率减缓的主要原因;CRAIG等[7]和KLAUBER等[8]研究认为,硫阻碍了矿物的进一步浸出;LAZARO等[9]和PARKER[10]研究认为,浸出速率的下降是由于在矿物表面形成金属缺陷型的多硫化物层阻碍了Cu2+ 和Fe2+ 的传输, 同时也减缓了反应中电子的传递。
实际上,浸出过程中产生的硫酸钙和铁沉淀也会降低微生物浸出硫化铜矿的速率,而关于这方面的研究报道不多。本文作者采用嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans,简称A.f)和嗜酸氧化硫硫杆菌(Acidithiobacillus thiooxidans,简称A.t)的混合菌,经实验室富集培养,针对宁夏某铜矿,考察了低品位硫化铜矿细菌浸出的可行性,同时考察了浸出过程中硫酸钙和铁沉淀对浸出速率的影响。
1 实验
矿样取自宁夏某铜矿,其主要矿石矿物为孔雀石、蓝铜矿、辉铜矿,脉石矿物为石英、方解石、高岭石、白云石及少量长石。矿样的XRD谱如图1所示。原矿多元素分析和铜物相分析结果如表1和2所列。铜的平均品位为0.32%,属低品位硫化铜矿。摇瓶试验矿样粒度小于0.074 mm的占90%;小型柱浸装矿2.10 kg,矿石粒度小于15 mm;大型柱浸装矿77.85 kg,矿石粒度小于25 mm。
细菌采自宁夏某铜矿酸性矿坑水中,经实验室富集培养、分离出嗜酸氧化亚铁硫杆菌(A.f)和嗜酸氧化硫硫杆菌(A.t),本实验将这两种菌混合进行硫化铜矿细菌浸出。
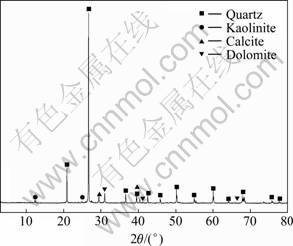
图1 原矿的XRD谱
Fig.1 XRD pattern of raw ore
表1 矿样的元素分析结果
Table 1 Results of element analysis of ore sample (mass fraction, %)

表2 铜的物相分析结果
Table 2 Mineralogical analysis results of copper
9K基础盐溶液的组成如下:(NH4)2SO4 3.0 g/L、KCl 0.1 g/L、K2HPO4 0.5 g/L、MgSO4·7H2O 0.5 g/L、Ca(NO3)2 0.01 g/L。
将配好的上述9K基础盐溶液冷却到60 ℃,培养嗜酸氧化亚铁硫杆菌(A.f )时加入44.7 g的FeSO4·7H2O;培养嗜酸氧化硫硫杆菌(A.t)时加入硫粉5 g。
取9K培养基95 mL置于250 mL的锥形瓶中,用稀硫酸调节pH值至1.8,加入5mL菌液,将锥形瓶置于恒温振荡器中,设定温度为30 ℃,转速为160 r/min。按同样的方法逐次减少接种量进行转移培养。经过反复转移培养使试验用细菌得以充分生长,使其活性增大,作为浸出试验细菌,在细菌生长对数期接种,进行浸出试验[11-12]。试验用血球计数板测定细菌生长数量。
1.3.1 摇瓶试验
摇瓶浸出试验在恒温振荡器上进行。取9K培养基95 mL置于250 mL的锥形瓶中,称量5 g矿样放入锥形瓶中,调节矿浆pH值,控制初始pH值在1.6~1.8,恒温振荡器温度为30 ℃,转速为160 r/min,细菌接种量为1.0×106。定期测定矿浆的pH值和电位,取矿浆上清液测定Cu2+的浓度,取样时浸出液损失用9K培养基补充,蒸发损失用二次蒸馏水补充。
1.3.2 小型柱浸试验
小型柱浸试验在d 70 mm×500 mm的PVC柱中进行,先将制备好的矿样均匀地装入浸出柱,再用 2 500 mL pH值为1.2的硫酸溶液反复渗洗矿石(浸出时间从酸洗开始计算),以中和部分碱性脉石,同时浸出少量氧化铜矿。当浸出液的pH值连续24 h恒定在1.8左右时,在浸出液中接种50 mL处于细菌生长对数期的活性菌液,并补充浸出液至2 500 mL。细菌浸出过程中,用体积比1:1的硫酸调节浸出液pH值,定期测定浸出液的pH值和氧化还原电位(相对于甘汞电极vs SCE), 并取样分析Cu2+ 的含量。在测定pH值、氧化还原电位及取样前用自来水补充浸出液的挥发损失。
1.3.3 大型柱浸试验
大型柱浸试验在生物浸出控制系统中进行, 浸出柱规格为d 210 mm×1 600 mm。先将制备好的矿样均匀地装入浸出柱,再用40.9 L pH 为1.2的硫酸溶液反复渗洗矿石(浸出时间从酸洗开始计算),以中和部分碱性脉石,同时浸出少量氧化铜矿。当浸出液的pH值连续24 h恒定在1.8左右时,在浸出液中接种8 L处于细菌生长对数期的活性菌液,并补充浸出液至40.9 L。细菌浸出过程中,用浓硫酸调节浸出液pH值,定期测定浸出液的pH值和氧化还原电位(甘汞电极电位),并取样分析Cu2+ 的含量。在测定pH值、氧化还原电位及取样前用自来水补充浸出液的挥发损失。原矿、小型柱浸浸渣及大型柱浸浸渣均采用混匀缩分方法获得具有代表性的样品,用于化学元素分析和X射线衍射分析。为监测柱浸过程中铜浸出率的变化情况,取浸出率分析其中的Cu2+含量,按此含量计算的铜浸出率为液计浸出率。实验结束后,对浸渣进行化学多元素分析,按渣中铜含量计算铜浸出率为渣计铜浸出率。由于柱浸实验时间长、取样次数多,不可避免会存在累积误差的损失,所以矿石中最终的铜浸出率由渣中铜含量计算得到。
溶液中金属离子的浓度用美国Baird公司生产的PS-6真空型等离子体发射光谱仪测定;pH值和氧化还原电位用雷磁PHSJ-4A酸度计测定;矿物及其浸渣的成分用德国Bruker-axsD& Advance的X射线衍射分析;浸渣表面形貌用J EOL公司生产的J SM26360LV 型扫描电镜分析。
2 结果与讨论
摇瓶试验进行了有菌和无菌两组对比试验,铜的浸出情况如图2所示,浸出液中Cu 、Fet浓度变化如图3所示。由图2可知,浸出55 d后,加菌浸出铜时最大浸出率达94.38%,无菌浸出铜时最大浸出率仅为29.75%。实验结果表明:低品位硫化铜矿的浸出受细菌控制,在细菌作用下铜浸出率大幅度提高。
细菌浸出过程中浸出液的pH值、矿浆电位(甘汞电极电位)变化如图4所示。由图4可知:在浸出初期,矿浆pH值升高,这是因为原矿含有较高的碱性脉石矿物(CaO 4.55%,MgO 1.29%);在浸出中后期, 矿浆pH值逐渐下降,浸出过程可能发生了如下反应[13]:
S0+3/2O2+H2O![]() 2H++
2H++![]() (1)
(1)
3Fe3++![]() +6H2O+M+
+6H2O+M+ ![]() MFe3(SO4)2(OH)6+6H+ (2)
MFe3(SO4)2(OH)6+6H+ (2)
4Fe2++O2+4H+![]() 4Fe3++2H2O (3)
4Fe3++2H2O (3)
式中:M为H+、Na+、K+ 或NH4+。
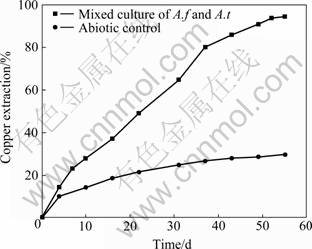
图2 摇瓶试验中铜浸出率的变化曲线
Fig.2 Changing curves of copper extraction in shake flasks

图3 摇瓶试验中Cu、Fet浓度的变化曲线
Fig.3 Concentration curves of copper and total iron content (Fet) in shake flasks

图4 摇瓶试验中矿浆的pH值和电位变化曲线
Fig.4 Changing curves of solution pH (a) and potential (b) in shake flasks
反应产生的酸量既弥补了浸出过程的酸耗,又使矿浆pH值稳定在1.4左右。矿浆电位逐渐升高,最后电位稳定在600 mV左右,在试验后期,电位又有所下降。这是因为矿石中的铁开始以Fe2+的形式溶出,由于嗜酸氧化亚铁硫杆菌对Fe2+氧化作用,Fe2+被氧化成Fe3+[14](见反应(3)),溶液中的Fe3+/Fe2+值逐渐增大,最后到达一较稳定的值,所以,矿浆电位逐渐升高最后稳定在600 mV左右;由图3可知,浸出的后期,浸出液中的铁浓度下降,这是因为部分Fe3+发生反应(2),形成黄钾铁矾沉淀,Fe3+/Fe2+值减小,所以,矿浆电位又有所下降。
小型柱浸试验选用2组,编号为柱浸1和2,二者装矿量均为2.1 kg。其中柱浸1柱浸在室温条件下进行,柱浸2 柱浸前105 d在室温下进行,105 d后室温低于20 ℃,为保证浸矿细菌对温度的要求,将柱浸2移到恒温水浴中进行(水浴温度为30 ℃),液计铜浸出率结果如图5所示。由图5可知:柱浸2实验的铜浸出率比柱浸1实验的高,浸出226 d后,为计算最终铜浸出率,对浸渣作化学多元素分析见表3所列。随着浸出时间的延长,柱浸1和2实验的铜浸出率都逐渐趋于稳定。按浸渣计算柱浸1和 2铜的浸出率分别为56.25%和62.50%。因为细菌最佳的生长温度是30 ℃,保持浸出体系在较稳定的温度范围内可以保持细菌良好的氧化活性,所以柱浸2的铜浸出效果较好。预浸35 d后,加入细菌。由图5还可以看出:加菌后铜浸出速率明显增加,但在中期铜的浸出速率逐渐下降,到后期铜浸出速率变得平缓。铜浸出率下降的原因可能是矿石表面形成致密的阻碍层。

图5 小型柱浸铜浸出率的变化曲线
Fig.5 Changing curves of copper extraction in small-scale column
大型柱浸试验液计铜浸出率结果如图6所示。大型柱浸浸渣化学多元素分析结果如表3所列,浸出285 d后,按浸渣计铜的浸出率为50.63%。由图6可以看出,随着浸出时间的延长,铜的浸出率逐渐趋于稳定。预浸22 d后,加入细菌;加菌后铜浸出速率明显增加,但在中期铜的浸出速率逐渐下降,到后期铜浸出速率变得平缓。铜浸出率下降的原因可能是矿石表面形成致密的阻碍层。
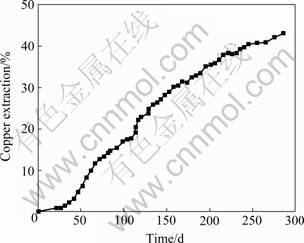
图6 大型柱浸铜浸出率的变化曲线
Fig.6 Changing curve of copper extraction in large-scale column
对柱浸1、2、大型柱浸的浸渣进行多元素分析,结果如表3所列。浸渣分析结果显示:原矿经柱浸后钙含量基本不变,而元素硫的含量明显增加,由原矿0.48%分别增至1.42%、1.49%和1.40%。原矿的钙物相分析结果如表4所列。由表4可知,原矿中钙主要以碳酸盐的形式存在,致使浸出时易被硫酸溶出而进入浸出液。由以上分析结果表明:原矿浸出后,钙主要以硫酸盐形式结晶覆盖于矿石的表面[15-16]。小型柱浸1和2、大型柱浸的浸渣XRD谱如图7所示,与原矿的XRD谱比较可知,浸渣中均存在新的石膏相。
为了观察经细菌浸出前、后矿石表面微观结构的变化情况,分别对原矿及柱浸后矿石表面进行扫描电镜分析,结果如图8所示。从图8可知,浸出前、后矿石表面的微观结构发生了明显的变化,图8(b)中出现较明显的板状和纤维状晶体结构,并对区域1和2进行放大处理,分别如图8(c)、(d)所示,结果表明,原矿浸出后表面形成大量致密纤维状、板状的CaSO4晶体及絮团状铁的沉淀体。因柱浸时矿石自然堆积,其表面与浸出液的接触部位、时间等条件均不相同,加之矿石嵌布形式复杂的特性导致其表面新生成的物质分布不均匀,即CaSO4晶体与铁的沉淀体间歇式包裹在矿石表面。原矿及浸出后矿石表面的微区分析结果如图9、表5所示。结果表明,浸出后矿石表面元素硫、钙、铁的含量明显增大。说明矿石表面硫酸钙和铁沉淀的存在。
表3 小型柱浸1和2、大型柱浸浸渣化学多元素分析结果
Table 3 Results of chemical analysis of residues from small-scale 1, 2 and large-scale column
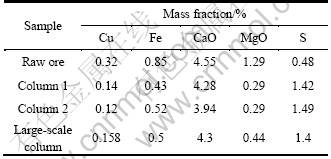
表4 钙物相分析结果
Table 4 Mineralogical analysis results of calcium
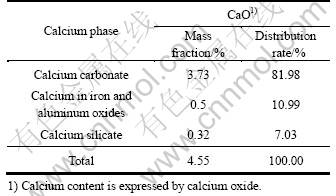
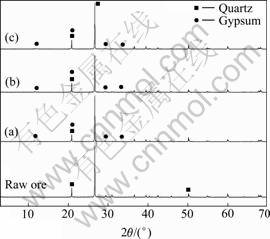
图7 小型柱浸1(a) 、2(b)、大型柱浸(c)的浸渣XRD谱
Fig.7 XRD patterns of residues from low-scale column 1(a), 2(b) and large-scale column(c)
由以上的浸渣分析和SEM分析结果表明:在浸出过程中产生的硫酸钙结晶覆盖在矿石表面,铁在矿石表面形成沉淀,使矿石的渗透性变差,从而成为浸出速率下降的主要原因。
 4
4
图8 浸出前、后矿石表面的SEM像
Fig.8 SEM images of ore surface: (a) Before leaching; (b) After leaching; (c) Microstructure of zone 1; (d) Microstructure of zone 2
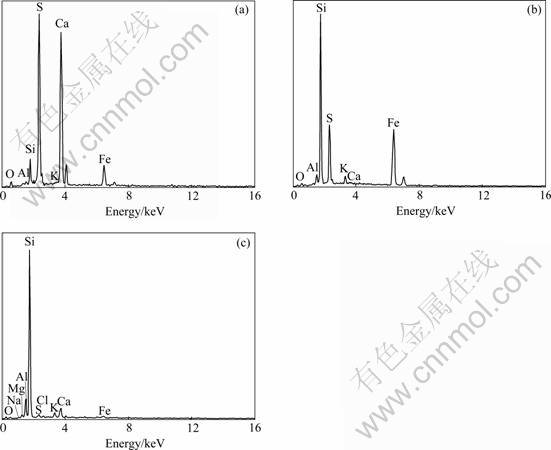
图9 区域1(a)、区域2(b)、原矿表面(c)的EDS谱
Fig.9 EDS spectra of zone 1 (a), zone 2 (b) and raw ore (c)
表5 区域1、区域2及原矿表面的能谱分析结果
Table 5 EDS results of zones 1, 2 and raw ore

3 结论
1) 低品位硫化铜矿可以用细菌浸出的方法有效地回收金属铜。
2) 保持浸出体系在稳定的温度范围内有利于保持细菌生长繁殖、保持良好的氧化活性,从而利于铜的浸出。
3) 低品位硫化铜浸出过程中浸出速率下降,除了与矿石性质、嵌布形式等内在因素有关外,还会受钙、铁等外在因素的影响。浸出过程中生成的硫酸钙在矿石的表面结晶,铁在矿石表面形成铁的沉淀体,形成致密的覆盖层,使矿石渗透性变差,浸出液及细菌不能与矿石中的目标组分充分接触,导致浸出速率下降。
REFERENCES
[1] WATLING H R. The bioleaching of sulphide minerals with emphasis on copper sulphides—A review[J]. Hydrometallurgy, 2006, 84: 81-108.
[2] 李秋元, 郑 敏, 王永生. 我国矿产资源开发对环境的影响[J]. 中国矿业,2002(2): 47-51.
LI Qiu-yuan, ZHENG Min, WANG Yong-sheng. Influences of mineral resource exploitation on environmental quality in China[J]. China Mining Magazine, 2002(2): 47-51.
[3] 戎志梅. 生物技术在资源与环境保护领域中的应用[J]. 化工科技市场,2002(7): 5-7.
RONG Zhi-mei. The application of biotechnology in the field of resource and environment protection[J]. Chemical Technology Market, 2002(7): 5-7.
[4] BHARATHI K, BHAGVANTH R M, LAKSHMI N M, RAVINDRA P. Effect of biochemical reactions in enhancement of rate of leaching[J]. Chemical Engineering Science, 2004, 59 (22/23): 5069-5073.
[5] SANDSTROM ?, SHCHUKAREV A, PAUL J. XPS characterisation of chalcopyrite chemically and bio-leached at high and low redox potential[J]. Minerals Engineering, 2005, 18: 505-515.
[6] THIRD K A, CORD-RUWISCH R, WATLING H R. The role of iron-oxidizing bacteria in stimulation or inhibition of chalcopyrite bioleaching[J]. Hydrometallurgy, 2000, 57: 225-233.
[7] CRAIG K, ANDREW P, WILHELM V B, HELEN W. Sulphur speciation of leached chalcopyrite surfaces as determined by X-ray photoelectron spectroscopy[J]. International Journal of Mineral Processing, 2001, 62(1/4): 65-94.
[8] KLAUBER C, PARKER A, BRONSWIJK W V, WATLING H. Sulphur speciation of leached chalcopyrite surfaces as determined by X-ray photoelectron spectroscopy[J]. Int J Miner Process, 2001, 62: 65-94.
[9] LAZARO I, NICOL M. The mechanism of the dissolution and passivation of chalcopyrite: An electrochemical study[C]// Proceedings of the TMS Fall Extraction and Processing Conference. Minerals, Metals and Materials Society, 2003(1): 405-417.
[10] PARKER A J. Electrochemistry of the oxidative leaching of copper from chalcopyrite[J]. Eletctroanal Chem, 1997(8): 118-305.
[11] ZHANG Yan-sheng, QIN Wen-qing, WANG Jun, ZHEN Shi-jie, YANG Cong-ren, ZHANG Jian-wen, NAI Shao-shi, QIU Guan-zhou. Bioleaching of chalcopyrite by pure and mixed culture[J]. Transactions of Nonferrous Metals Society of China, 2008, 18(6): 1491-1496.
[12] ZENG Wei-min, WU Chang-bin, ZHANG Ru-bing. Isolation and identification of moderately thermophilic acidophilic iron-oxidizing bacterium and its bioleaching characterization[J]. Transactions of Nonferrous Metals Society of China, 2009, 19(1): 222-227.
[13] VILCA′EZ J, SUTO K, INOUE C. Response of thermophiles to the simultaneous addition of sulfur and ferric ion to enhance the bioleaching of chalcopyrite[J]. Minerals Engineering, 2008, 21: 1063-1074.
[14] RODR?GUEZ Y, BALLESTER A, BI?ZQVEZ M L, GONZ?LEZ F, MU?OZ J A. New information on the chalcopyrite bioleaching mechanism at low and high temperature[J]. Hydrometallurgy, 2003, 71: 47-56.
[15] SINGH N B, MIDDENDORF B. Calcium sulphate hemihydrate hydration leading to gypsum crystallization[J]. Progress in Crystal Growth and Characterization of Materials, 2007, 53: 57-77.
[16] HAMDONA S K, ALHADAD U A. Crystallization of calcium sulfate dihydrate in the presence of some metal ions[J]. International Journal of Mineral Processing, 2007, 299: 146-151.
(编辑 龙怀中)
基金项目:国家重点基础研究发展计划项目(2010CB630905);国家高技术研究发展计划重点项目(2007AA060902)
收稿日期:2010-05-05;修订日期:2010-12-07
通信作者:覃文庆,教授,博士;电话:0731-88830884;E-mail: qinwenqing1@126.com


