DOI: 10.11817/j.ysxb.1004.0609.2020-35765
As(Ⅴ)-Fe(Ⅱ)体系常压臭葱石合成过程过饱和度对形貌和稳定性的影响
王长印,李旻廷,魏 昶,李兴彬,邓志敢,刘慧杨,雷佛光
(昆明理工大学 冶金与能源工程学院,昆明 650093)
摘 要:
针对低溶液过饱和度是常压臭葱石合成过程的关键要素这一问题,本文在As(Ⅴ)-Fe(Ⅱ)体系下,通过Fe2+缓慢氧化来控制溶液过饱和度,研究了pH对Fe2+氧化速率的影响、Fe2+氧化速率与过饱和度的关系和过饱和度对砷铁沉淀率、臭葱石组分含量、颗粒粒径、形貌及其稳定性的影响。结果表明,Fe2+的氧化速率随初始pH值的降低而降低,而溶液过饱和度随Fe2+氧化速率的降低而降低。较低的初始过饱和度不利于砷铁的沉淀,对渣中砷铁含量影响不显著,但对渣中硫含量影响较大。初始过饱和度从7.86升至78.86时,砷、铁沉淀率分别从77.05%、53.9%升至88.66%、61.79%,渣中砷、铁和硫含量分别为30.74%、24.14%和0.58%~0.17%。臭葱石颗粒粒径随初始过饱和度的增加而先增加后减小,初始过饱和度值为11.7时,颗粒尺寸达到最大87.5 μm。初始过饱和度为7.86~24时,形成类球型臭葱石颗粒;初始过饱和度值为24~78.86时,形成无规则型臭葱石颗粒。通过控制初始过饱和度在7.86~78.86下,合成的臭葱石稳定性高,其浸出毒性均小于1 mg/L。
关键词:
文章编号:1004-0609(2020)-04-0896-10 中图分类号:TF09 文献标志码:A
砷元素并不是人体的必需元素,砷的化合物具有毒性,对人体健康有很大的危害[1-4]。而且As3+的毒性比As5+的毒性大,有机砷的毒性大于无机砷的毒性[5-6]。砷可以使器官异常改变甚至癌变,砷是国际公认的致癌物质[7]。矿业活动是导致砷污染的主要原因之一,其排放的砷量占全球人为活动向环境排放砷量的72.6%[8],其中有色金属工业又是含砷污染物的主要来源。由于砷化合物市场有限,除少部分含砷物料可以用于生产砷化合物外,大部分含砷物料应进行固化、稳定化处理而非资源化利用。
固砷技术主要包括包封和矿物固砷两类。包封是用水泥、玻璃等材料,对含砷物料进行包覆,使其能够稳定堆存。这一方法固废量大、成本高,难以广泛应用。矿物固砷是将砷转化为含砷矿物后堆存,通常采用化学沉淀的方法,如钙盐(或钙盐-铁盐)、铝盐、镁盐和硫化沉淀法等。但砷酸钙并不适合长期稳定堆存,其原因在于空气中的CO2会使得砷酸钙转化为碳酸钙,使砷被释放而污染环境[9-11]。硫化法所得沉淀易受空气氧化和环境中细菌的侵蚀而溶解,使砷再次进入环境中,亦不适合长期堆存。铝盐和镁盐沉淀法所得沉淀稳定性不高,且对砷的脱出效果并不理想,不是最佳的固砷载体[12-13]。
基于天然臭葱石能稳定存在于自然环境下的认识,对合成臭葱石稳定性开展了大量研究,并逐步取得了高稳定性的共识。因臭葱石具有含砷量高、稳定性高、堆存费用低等优点,将砷以臭葱石的形式进行稳定固化是现今研究的热点,也是目前国际公认的最佳固砷载体[14]。目前,臭葱石合成的方法主要有传统水热法、常压法、改进常压法。
传统水热合成方法需要在高温(150 ℃)高压和一定pH值条件下进行。DUTRIZAC等[15-16]针对Fe(NO3)3-As(V)体系,用H2SO4调节pH值,在160 ℃条件下,第一次在实验室制备出结晶良好的臭葱石。余自秀等[17]和张俊等[18]采用水热法,在高温高压下通过Fe2+氧化控制过饱和度来合成臭葱石。由于在高温高压条件下,Fe2+氧化速率快,晶核形核速率快,形成的臭葱石粒度较小。水热合成法的主要缺点是:一方面,对生产设备要求高、生产成本高;另一方面,由于高温条件下溶液过饱和度较大,导致合成的臭葱石粒度较细,一般小于10 μm。
针对水热合成过程溶液过饱和度较大的问题,如何降低过饱和度以实现大颗粒臭葱石的合成引起了广泛关注。为此,DEMOPOULOS等[19-20]研究了低于100 ℃温度下晶态砷酸铁的合成,证明了在常压下合成砷酸铁结晶是可行的。上述方法通过严格控制pH值的临界状态(一般为0.9)和添加晶种两个关键技术来控制较低的溶液过饱和度,使溶液过饱和度低于临界过饱和度(Scr=100),获得的臭葱石颗粒尺寸较大(15 μm),其浸出毒性小于0.35 mg/L。CAETANO等[21]在间歇和连续条件下,以稀释的As3+溶液(砷浓度0.1~1 g/L)为研究对象,通过调节pH值和添加晶种来合成臭葱石,发现初始过饱和度(S)在10~40范围内,其浸出毒性为0.65 mg/L。后来王宽岭[22]采用逐渐向酸溶液中加入砷铁溶液来控制过饱和度合成臭葱石,其浸出砷浓度为2.3 mg/L,但在实际应用中通过此方法控制过饱和度操作较为繁琐、工艺复杂。DEMOPOULOS等[20]认为,在常压下,只有当溶液过饱和度(S)小于某一临界值(Scr=100)时,才能形成晶态臭葱石;而当溶液过饱和度大于该临界值时,将产生无定形砷酸铁沉淀。因此,常压下低的溶液过饱和度是臭葱石合成的关键要素。
为了进一步降低常压体系下的溶液过饱和度,日本研究者FUJITA等[23-24]提出了改进常压法,采用Fe2+的缓慢氧化来控制过饱和度,获得了较大颗粒尺寸(10~15 μm)的晶态臭葱石,浸出砷浓度为0.48 mg/L。
综上所述,目前关于常压体系下臭葱石的合成已有较多的文献报道,主要聚焦于晶态高稳定臭葱石的合成,但关于过饱和度对臭葱石的形貌和稳定性的影响鲜有报道。国内外研究者已有采用不同方法来控制溶液过饱和度,但均未涉及溶液过饱和度对臭葱石形貌和稳定性的影响规律的研究。因此,本文在As(Ⅴ)-Fe(Ⅱ)溶液体系下,研究了过饱和度对臭葱石合形貌及稳定性的影响,考察了初始pH与Fe2+氧化速率和初始过饱和度的关系,以及过饱和度对砷铁沉淀率、沉砷渣物相组成、形貌、粒度分布和稳定性的影响规律。
1 实验
1.1 实验原料及设备
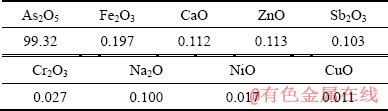
本研究所用的实验原料包括:五氧化二砷为砷源(As2O5,云南某冶炼公司,化学成分如表1所示)、七水硫酸亚铁为铁源(FeSO4·7H2O,分析纯)、硫酸(98%,分析纯)、工业氧气(O2纯度大于99.5%)。
表1 五氧化二砷化学成分表
Table 1 Chemical composition of As2O5 (mass fraction, %)
本研究所采的实验装置图如图1所示。为了使实验反应温度保持恒定,故采用气体预热装置,从而减小实验结果的偏差。
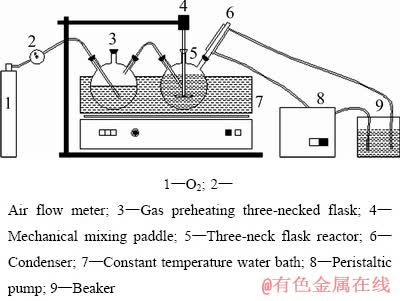
图1 实验装置
Fig. 1 Schematic diagram of experimental setup
1.2 实验方法
将As2O5和FeSO4·7H2O按铁砷摩尔比1.5配制含砷40 g/L的1 L含砷铁的溶液,采用硫酸调节初始pH值至设定值。采用2 L的三口烧瓶为反应容器。将配制好的含砷铁溶液加入到三口烧瓶后,打开恒温水浴锅开始加热升温,当反应溶液温度达到预定值,通入氧气,同时打开搅拌装置并将转速调至设定值,反应开始计时。在不同的反应时间点取样(每次取5 mL,取样总体积为35 mL),采用真空抽滤装置进行固液分离,测量所得滤液体积,测滤液砷铁浓度。将滤渣置于500 mL去离子水中洗涤(洗涤3次),液固分离后,置于 70 ℃的电热鼓风干燥箱干燥24 h,计算湿重含水率并检测渣中砷铁硫含量。
1.3 分析与检测
采用ELAN600型电感耦合等离子体发射光谱(ICP-AES,美国Perkin-Elmer公司)分析溶液中的砷铁含量,原子吸收光谱仪(美国铂金埃尔默公司)分析渣中砷铁含量,D/max-2200型X射线衍射仪(XRD,日本理学公司)表征沉砷渣的物相组成,VEGA3SBH型扫描电镜(SEM,德国VEGA物位仪表公司)表征沉砷渣的形貌,Size-2000型激光粒度仪(丹东百特仪器有限公司)对沉砷渣的粒度分布进行分析。
2 结果与讨论
2.1 初始pH对Fe2+氧化速率的影响
臭葱石合成过程,过饱和度是溶液结晶成核和生长的主要推动力[25],pH是影响Fe2+氧化速率的重要因素,Fe2+氧化速率直接影响Fe3+的浓度,而Fe3+的浓度直接影响臭葱石合成过程过饱和度大小。为此,研究了不同初始pH值条件下的Fe2+氧化速率。在初始砷浓度40 g/L、初始铁砷摩尔比1.5、搅拌转速400 r/min、反应温度90 ℃、氧气流量60 L/h、反应时间15 h的条件下,通过改变溶液初始pH值,研究了溶液初始pH值对Fe2+氧化率的影响,Fe2+氧化率采用式(1)计算,计算结果如图2所示。
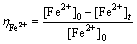 (1)
(1)
式中: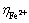 为Fe2+氧化速率,%;
为Fe2+氧化速率,%; 为某时刻Fe2+的浓度,g/L;
为某时刻Fe2+的浓度,g/L;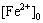 为初始Fe2+的浓度,g/L。
为初始Fe2+的浓度,g/L。
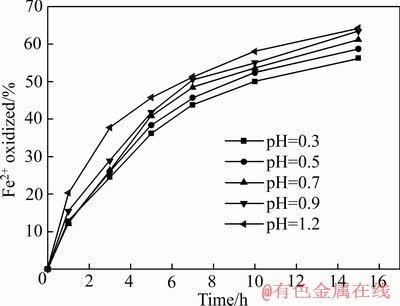
图2 不同初始pH值对Fe2+氧化率的影响
Fig. 2 Effect of different initial pH values on Fe2+ oxidation
从图2可以看出,不同初始pH值对Fe2+氧化率影响显著。Fe2+氧化率随初始pH值降低而降低;不同初始pH值条件下,随着反应时间延长,Fe2+氧化率逐渐升高并且氧化速率逐渐变慢,这是由于臭葱石合成过程是一个产酸的过程,化学反应方程式如下:
Fe2+(aq)+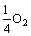 +H+=Fe3++3H2O (2)
+H+=Fe3++3H2O (2)
Fe3+(aq)+H3AsO4(aq)+2H 2O=FeAsO4·2H2O(s)+3H+ (3)
臭葱石合成过程中,溶液初始pH值随反应时间变化如图3所示。随着反应时间延长,溶液pH值逐渐降低,酸度增大,氧溶解的饱和浓度降低[26-28],Fe2+氧化率也随之减小。
为了研究Fe2+的氧化动力学,采用如下方程对实验数据进行拟合[29]:
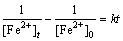 (4)
(4)
式中: 为某时刻Fe2+的浓度,g/L;
为某时刻Fe2+的浓度,g/L;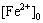 为初始Fe2+的浓度,g/L;k为反应速率常数;t为时间,h。
为初始Fe2+的浓度,g/L;k为反应速率常数;t为时间,h。
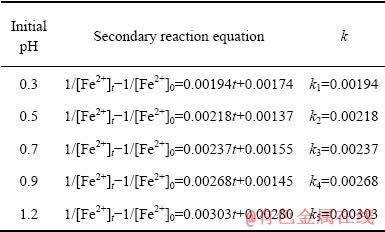
数据拟合结果如图4所示。由图4可知,不同初始pH值条件下线性相关系数R2值在0.96以上,表明本实验条件下Fe 2+氧化为二级反应。根据图4中的斜率计算了Fe2+氧化速率常数k,结果列入表2。由表2可知,随着初始pH值的减小,反应速率k值随之减小,即Fe 2+氧化速率降低。
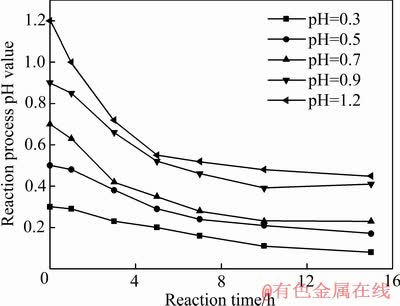
图3 不同初始pH值随反应时间的变化
Fig. 3 Change of initial pH value with reaction time
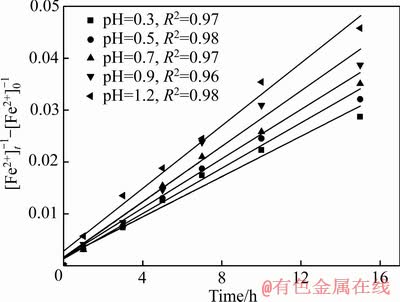
图4 不同初始pH值下Fe2+氧化动力学曲线
Fig. 4 Kinetic curves of Fe2+ oxidation at different initial pH values
表2 不同初始pH值下Fe2+氧化速率常数k值
Table 2 Fe2+ oxidation rate constant k value at different initial pH values
2.2 Fe2+氧化速率与溶液过饱和度的关系
常压臭葱石合成过程要求在低过饱和度下进行。当过饱和度低于临界过饱和度S cr时,臭葱石均相成核开始;当过饱和度高于该临界值时,将形成砷酸铁无定形沉淀[20]。本研究通过Fe2+的缓慢氧化来控制较低的过饱和度,为此,研究了Fe2+氧化速率与过饱和度的关系。在常压合成臭葱石过程中,关于溶液过饱和度的计算已有研究者进行了研究。
MERSMANN[30]将通式为AxBy的固体溶解的阴阳离子定义了相对过饱和度,其计算公式如下:
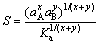 (5)
(5)
式中:aA和aB为离子活性;Ka为某温度下的平衡常数。
DEMOPOULOS等[20]在Fe(Ⅲ)和As(Ⅴ)体系下合成臭葱石,采用过饱和比来表达溶液过饱和度,反应方程式如式(2),过饱和度S的计算公式如下:
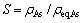 (6)
(6)
式中: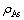 是反应体系中实际砷浓度,g/L;
是反应体系中实际砷浓度,g/L;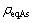 是砷的平衡浓度,g/L。
是砷的平衡浓度,g/L。
本研究是在Fe(Ⅱ)和As(Ⅴ)体系下,Fe2+氧化为Fe3+,Fe3+和As5+反应合成臭葱石,其过饱和度计算公式[21]如下:
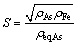 (7)
(7)
式中: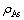 和
和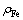 是砷和Fe(Ⅲ)的实际测量浓度,g/L;
是砷和Fe(Ⅲ)的实际测量浓度,g/L;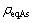 是砷的平衡浓度,g/L,其中
是砷的平衡浓度,g/L,其中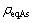 数据来自文献[20]。
数据来自文献[20]。
砷铁离子浓度随反应时间变化如图5和6所示,根据图5和6中数据采用式(7)计算不同Fe2+氧化速率下的过饱和度,结果如图7所示。
由图7可知,初始过饱和度随Fe2+氧化速率k值增大而升高。随着反应时间的延长,过饱和度逐渐降低,其原因是随着时间延长,臭葱石合成过程逐渐产酸,pH值降低,抑制了Fe2+氧化速率,导致过饱和度降低。在反应时间3 h内,初始pH值从1.2降低到0.7时,Fe2+氧化速率k值分别从0.00303降低到0.00237,初始过饱和度迅速降低,分别由78.88、44.38、24降至8.68、12.19、8.32,其原因主要是Fe2+氧化反应速率k值减小,Fe2+氧化率降低,有利于晶核形核速率,导致过饱和度迅速降低。在反应3 h内,初始pH值从0.5降低到0.3时,Fe2+氧化速率k值从0.00218降至0.00194,初始过饱和度降低缓慢,分别由11.7、7.86降至6.37、6.04,主要由于Fe2+氧化速率慢,导致过饱和度值降低缓慢。
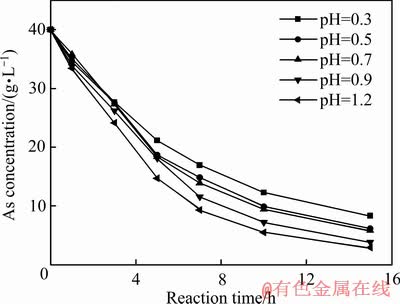
图5 砷离子浓度随反应时间的变化
Fig. 5 Arsenic ion concentration changes with reaction time
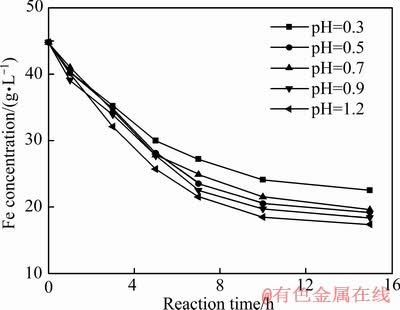
图6 铁离子浓度随反应时间的变化
Fig. 6 Iron ion concentration changes with reaction time
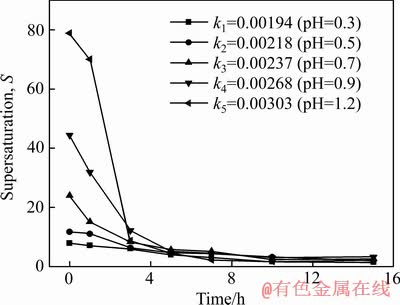
图7 不同Fe2+氧化速率下过饱和度随反应时间的变化
Fig. 7 Change of supersaturation with reaction time at different Fe2+ oxidation rates
在通过控制Fe2+氧化速率的条件下,过饱和度均低于DEMOPOULOS等[20]研究的体系下的过饱和度(S=40~90)。在低过饱和度条件下,有利于均相成核,抑制成核速率,促进晶体的生长。
2.3 初始过饱和度对铁砷沉淀率和臭葱石组分的影响
初始过饱和度对砷、铁沉淀率的影响如图8所示。由图8可知,溶液初始过饱和度对砷铁沉淀率有一定的影响。随着溶液初始过饱和度升高,砷铁沉淀率升高。初始过饱和度从7.86升高到78.88时,沉砷率、沉铁率分别从77.05%、53.90%升高到88.66%、61.79%。

图8 初始过饱和度对砷、铁沉淀率的影响
Fig. 8 Effects of initial supersaturation on arsenic and iron precipitation rates
图9所示为初始过饱和度对臭葱石中砷、铁、硫含量的影响。由图9可知,初始过饱和度从8.11升高到78.88时,臭葱石中砷铁含量变化不明显,分别为30%、 24%。随着初始过饱和度的增加(pH值升高),臭葱石中硫含量逐渐降低。FUJITA等[31]研究了在Fe(Ⅱ)与As(Ⅴ)体系中合成臭葱石,发现随着初始pH值降低,臭葱石中硫含量随之增加,他们认为可能是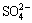 替代
替代 而进入臭葱石晶格中;DUTRIZAC等[32-33]在研究含砷溶液合成黄钾铁矾化合物沉淀过程中发现,
而进入臭葱石晶格中;DUTRIZAC等[32-33]在研究含砷溶液合成黄钾铁矾化合物沉淀过程中发现,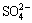 替代
替代 进入黄钾铁矾化合物中。
进入黄钾铁矾化合物中。
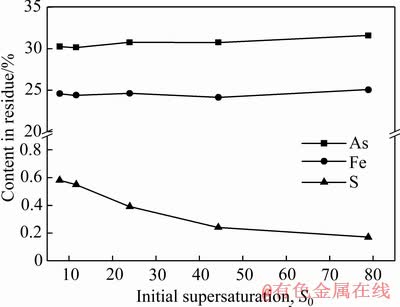
图9 初始过饱和度对沉淀物中砷、铁和硫含量影响
Fig. 9 Effects of initial supersaturation on As, Fe and S contents in residue
2.4 初始过饱和度对颗粒尺寸的影响
图10(a)所示为初始过饱和度对臭葱石粒度分布的影响。根据图10(a)计算出臭葱石颗粒平均粒径,如图10(b)所示。初始过饱和度小于11.7时,随着初始过饱和度升高颗粒尺寸增大,初始过饱和度值为7.86时,所得臭葱石平均粒径为67.1 μm。在初始过饱和度为11.7~24范围内,沉砷渣平均粒度变化不大(87.5~85.5 μm),有利于合成大颗粒的臭葱石。初始过饱和度大于24时,臭葱石颗粒的平均粒径逐渐降低,主要是较高的过饱和度,形核速率增加,而晶体生长速率降低。实验表明,在低过饱和度条件下合成的臭葱石粒度(平均直径58.3~87.5 μm)均大于SHINODA等[34]在常压条件下合成的臭葱石粒度(平均直径15 μm)。表明控制较低的溶液过饱和度有利于大颗粒臭葱石的合成。
2.5 初始过饱和度对臭葱石形貌的影响
初级成核一般发生在过饱和度区域,在成核后,随着溶质分子的形成和团聚,当晶核达到一定尺寸时,晶体开始生长。在晶体生长过程中,过饱和度影响着不同晶面的生长速率,从而影响晶体的形貌[35]。为此,研究了初始过饱和度对臭葱石形貌的影响,如图11所示。
由图11可知,初始过饱和度对沉淀物的形貌有显著的影响。初始过饱和度分别为7.86、11.7和24时,低过饱和度抑制了成核速率,使形核速率小于晶体生长速率,促进了晶体聚集长大[36-37],晶体主要为团聚的类球型颗粒,与FUJITA等[31]研究条件下合成的臭葱石颗粒形貌相一致。当初始过饱和度分别为44.38和78.86时,随着初始过饱和增大,促进了晶体成核速率,使晶体成核速率大于晶体生长速率,合成了无规则的团聚颗粒。图12所示为不同初始过饱和度下臭葱石沉淀的XRD谱。
由图12可知,不同初始过饱和度下所得沉淀物均为晶型臭葱石。据相关研究者[38-39]报道,酸度较高的条件(pH<1)有利于合成良好晶型臭葱石。
2.6 初始过饱和度与臭葱石的稳定性关系
图13所示为初始过饱和度与臭葱石稳定性的关系。由图13可知,当初始过饱和度从7.86增加到24时,臭葱石颗粒尺寸逐渐增大,而砷的浸出浓逐渐升高。其原因是较低的过饱和度下(低pH值下),臭葱石中硫含量增加(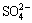 替代
替代 )影响臭葱石的稳定性,其影响机理尚有待进一步研究。当初始过饱和度从24增加到78.88时,臭葱石颗粒尺寸逐渐减小,砷的浸出浓度随之减小。研究表明,在控制低初始过饱和度值条件下有利于合成高稳定性晶型臭葱石颗粒,其浸出毒性均小于1 mg/L(GB 5085.3—2007,As的浸出毒性标准值为5.0 mg/L),有利于长期储存。
)影响臭葱石的稳定性,其影响机理尚有待进一步研究。当初始过饱和度从24增加到78.88时,臭葱石颗粒尺寸逐渐减小,砷的浸出浓度随之减小。研究表明,在控制低初始过饱和度值条件下有利于合成高稳定性晶型臭葱石颗粒,其浸出毒性均小于1 mg/L(GB 5085.3—2007,As的浸出毒性标准值为5.0 mg/L),有利于长期储存。

图10 初始过饱和度对臭葱石粒度分布及平均粒径的影响
Fig. 10 Effect of initial supersaturation on particle size grading(a) and average particle size(b) of scorodite
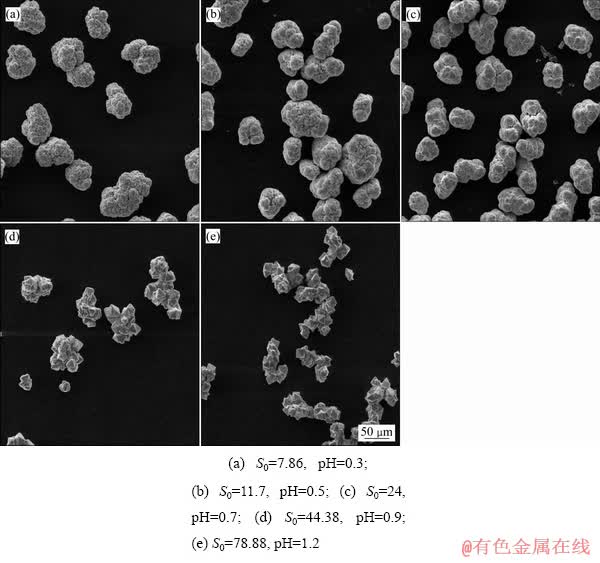
图11 不同初始过饱和度下所得沉淀SEM像
Fig. 11 SEM images of precipitate produced at various initial super- saturation
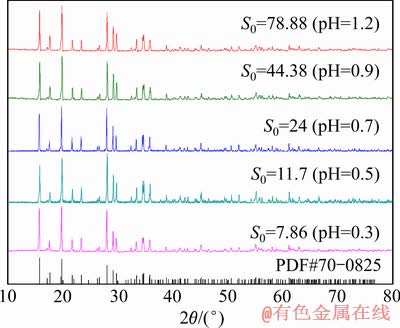
图12 不同初始过饱和度下所得沉淀物的XRD谱
Fig. 12 XRD patterns of precipitates produced at various initial supersaturation
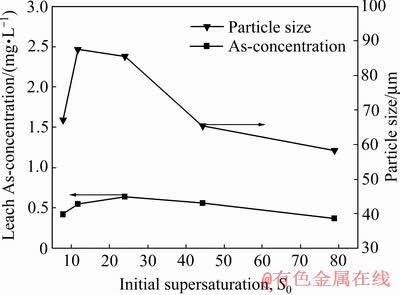
图13 不同初始过饱和度与臭葱石稳定性的关系
Fig. 13 Relationship between different initial supersaturation and scorodite stability
3 结论
1) 溶液初始pH值对Fe2+氧化速率有显著的影响。通过控制Fe2+氧化速率,能够控制较低的过饱和度。溶液过饱和度随Fe2+氧化速率降低而降低,Fe2+氧化速率k值从0.00303减小至0.00194时,初始过饱和度从78.88降低至7.86。
2) 初始过饱和度升高有利于提高砷铁沉砷率,降低渣中硫含量,但对渣中砷铁含量影响不显著。初始过饱和度从7.86升至78.88,砷铁沉淀率分别从77.05%、53.90%升至88.66%、61.79%,渣中硫含量从0.58%降至0.17%,而渣中砷铁含量分别为30.74%、24.14%。
3) 初始过饱和度为7.86~24时,有利于晶体长大,形成了类球形臭葱石颗粒;当初始过饱和度为44.38~78.86时,有利于晶核形核速率,形成了无规则团聚型臭葱石颗粒。
4) 随着初始过饱和度升高,臭葱石颗粒尺寸先增大后减小;初始过饱和度为11.7时,臭葱石颗粒的平均粒度为87.5 μm。随着初始过饱和度升高,砷的浸出浓度先升高后减小,其砷的浸出毒性均小于1 mg/L,具有良好的稳定性。
REFERENCES
[1] 沈 忱, 闵小波, 史美清, 周波生, 赵宗文, 李辕成, 张 纯. 砷滤饼的铜砷分离[J]. 中国有色金属学报, 2017, 27(2): 356-362.
SHEN Chen, MIN Xiao-bo, SHI Mei-qing, ZHOU Bo-sheng, ZHAO Zong-wen, LI Yua n-cheng, ZHANG Chun. Separation of copper and arsenic in arsenic filtration cake[J]. The Chinese Journal of Nonferrous Metals, 2017, 27(2): 356-362.
[2] 易 宇, 石 靖, 田庆华, 郭学益. 高砷烟尘氢氧化钠-硫化钠碱性浸出脱砷[J]. 中国有色金属学报, 2015, 25(3): 806-814.
YI Yu, SHI Jing, TIAN Qing-hua, GUO Xue-yi. Arsenic removal from high-arsenic dust by NaOH-Na2S alkaline leaching[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(3): 806-814.
[3] STATES J C, BARCHOWSKY A, CARTWRIGHT I L, REICHARDJ F, FUTSCHER B W, LANTZ R C. Arsenic toxicology: Translating between experimental models and human athology[J]. Environmental Health Perspectives, 2011, 119(10): 1356-1363.
[4] 乔晋玺, 龙 双, 马雅琳, 邱 洋, 陈敬阳, 苗华磊, 陈爱良. 空气氧化碱浸含砷钴镍渣[J]. 中国有色金属学报,2018, 28(11): 2358-2365.
QIAO Jin-xi, LONG Shuang, MA Ya-lin, QIU Yang, CHEN Jing-yang, MIAO Hua-lei, CHEN Ai-liang. Alkali leaching of cobalt/nickel residue containing arsenic using air[J]. The Chinese Journal of Nonferrous Metals, 2018, 28(11): 2358-2365.
[5] PETRICK J S, AYALA-FIERRO F, CULLEN W R, CARTER D E, APOSHIANHV. Monomethylarsonous Acid (MMAIII) Is more toxic than arsenite in chang human hepatocytes[J]. Toxicol Appl Pharmacol, 2000, 163(2): 203-207.
[6] VAHTER M. Mechanisms of arsenic biotransformation[J]. Toxicology, 2002, 181: 211-217.
[7] THOMPSON D J. A chemical hypothesis for arsenic methylation in mammals[J]. Chemico-Biological Interactions, 1993, 88(2/3): 89-114.
[8] HAN F X, SU Y, MONTS D L, DAVID L, MONTS M, GLOVERE. Assessment of global industrial-age anthropogenic arsenic contamination[J]. Naturwissenschaften, 2003, 90(9): 395-401.
[9] ROBINS R G. The solubility of metal arsenates[J]. Metallurgical Transactions B, 1981, 12(1): 103-109.
[10] 刘辉利, 朱义年. CO2对砷酸钙稳定性影响的热力学分析[J]. 环境保护科学, 2006, 32(3): 7-10.
LUI Hui-li, ZHU Yi-nian. Thermodynamic analysis of the CO2 effects on the stability of calcium arsenates[J]. Environmental Protection Science, 2006, 32(3): 7-10.
[11] BING P, JIE L,MIN X B,CHAI L Y,LIANG Y J,YOU Y. Physicochemical properties of arsenic-bearing lime–ferrate sludge and its leaching behaviors[J]. Transactions of Nonferrous Metals Society of China, 2017, 27(5): 1188-1198.
[12] 王化周. 镁盐污水脱砷的研究[J]. 大连工学院学报, 1980, 19(4): 83-92.
WANG Hua-zhou. A study of the dearenization by magnesium salts[J]. Journal of Dalian Institute of Technology, 1980, 19(4): 83-92.
[13] 饶金元, 朱 云. 从含砷银矿浸出液中脱砷[J]. 中国钼业, 2008, 32(5): 22-24.
RAO Jin-yuan, ZHU Yun. dearsenization from leaching liquid of arsenic-containing silver ore[J]. China Molybdenum, 2008, 32(5): 22-24.
[14] 李 艺, 赖来仁. 臭葱石的初步矿物学研究[J]. 矿产与地质, 2003, 17(2): 170-172.
LI Yi, LAI Lai-ren. Preliminary minera logical study of scorodite[J]. Mineral Resources and Geology, 2003, 17(2): 170-172.
[15] DUTRIZAC J E, JAMBOR J L. The synthesis of crystalline scorodite FeAsO4·2H2O[J]. Hydrometallurgy, 1988, 19(3): 377-384.
[16] DUTRIZAC J E, JAMBOR J L, CHEN T T. The behaviour of arsenic during jarosite precipitation: reactions at 150 ℃and the mechanism of arsenic precipitation[J]. Canadian Metallurgical Quarterly, 1987, 26(2): 103-115.
[17] 余自秀, 李存兄, 魏 昶, 樊 刚, 李兴彬, 邓志敢, 李旻廷. 砷铁水热共沉淀制备大颗粒臭葱石[J]. 过程工程学报, 2018, 18(1): 126-132.
YU Zi-xiu, LI Cun-xiong, WEI Chang, FAN Gang, LI Xing-bing, DENG Zhi-gan, LI Min-ting. Preparation of large-sized scorodite based on arsenic and iron hydrothermal co-precipitation[J]. The Chinese Journal of Process Engineering, 2018, 18(1): 126-132.
[18] 张 俊, 李存兄, 魏 昶, 樊 刚 李兴彬, 邓志敢, 李旻廷, 张 鹏. 含砷废水水热法臭葱石沉砷[J].中国有色金属学报, 2019, 29(6): 1729-1288.
ZHANG Jun, LI Cun-xiong, WEI Chang, FAN Gang, LI Xing-bin, DENG Zhi-gan, LI Min-ting, ZHANG Peng. Scorodite precipitation from arsenic-containing wastewater by hydrothermal method[J]. The Chinese Journal of Nonferrous Metals, 2019, 29(6): 1729-1288.
[19] DEMOPOULOS G P, DROPPERT D J, VAN WEERT G. Precipitation of crystalline scorodite (FeAsO4·2H2O) from chloride solutions[J]. Hydrometallurgy, 1995, 38(3): 245-261.
[20] DEMOPOULOS G P, DROPPERT D J, WEERT G V. Options for the immobilization of arsenic as crystalline scorodite[J]. Impurity Control and Disposal in Hydrometallurgical Processes, 1994, 23(25): 57-69.
[21] CAETANO M L, CIMINELLI V S T, ROCHA S D F, SPITALE M C, CALDEIRA C L. Batch and continuous precipitation of scorodite from dilute industrial solutions[J]. Hydrometallurgy, 2009, 95(1/2): 44-52.
[22] 王宽岭. 臭葱石合成方法及稳定性研究[D]. 北京: 中国科学院大学, 2013: 45-68.
WANG Kuan-lin. Synthesis and the stability of scorodite[D]. Beijing: University of Chinese Academy of Sciences, 2013: 45-68.
[23] FUJITA T, TAGUCHI R, ABUMIYA M,MATSUMOYO M, SHIBATA E, NAKAMURA T. Novel atmospheric scorodite synthesis by oxidation of ferrous sulfate solution. Part Ⅰ[J]. Hydrometallurgy, 2008, 90(2/4): 92-102.
[24] FUJITA T, TAGUCHI R, ABUMIYA M, MATSUMOYO M, SHIBATA E, NAKAMURA T. Novel atmospheric scorodite synthesis by oxidation of ferrous sulfate solution. Part Ⅱ. Effect of temperature and air[J]. Hydrometallurgy, 2008, 90(2/4): 85-91.
[25] 张 瑞. 结晶过程晶体形貌, 多维粒度和面生长动力学的在线实时测量[D]. 广州: 华南理工大学, 2016: 4-10.
ZHANG Rui. On-line real-time characterization of crystal shape, multidimensional sizes and facet growth kinetics in crystallization processes[D]. Guangzhou: South China University of Technology, 2016: 4-10.
[26] DAS T N. Saturation concentration of dissolved O2 in highly acidic aqueous solutions of H2SO4[J]. Industrial Engineering Chemistry Research, 2005, 44(6): 1660-1664.
[27] KASKIALA T. Determination of oxygen solubility in aqueous sulphuric acid media[J]. Minerals Engineering, 2002, 15(11): 853-857.
[28] NARITA E, LAWSON F, HAN K N. Solubility of oxygen in aqueous electrolyte solutions[J]. Hydrometallurgy, 1983, 10(1): 21-37.
[29] YUAN F. Study on kinetics of Fe(Ⅱ) oxidized by air in FeSO4-H2SO4 solutions[J]. Minerals Engineering, 2018, 121: 164-168.
[30] MERSMANN A. Crystallization technology handbook[M]. New York: Taylor Francis Inc, 2001: 832.
[31] FUJITA T, TAGUCHI R, ABUMIYA M, MATSUMOTO M,SHIBATA E, NAKAMURA T. Effect of pH on atmospheric scorodite synthesis by oxidation of ferrous ions: Physical properties and stability of the scorodite[J]. Hydrometallurgy, 2009, 96(3): 189-198.
[32] DUTRIZAC J E, JAMBOR J L. The behaviour of arsenic during jarosite precipitation: arsenic precipitation at 97 ℃ from sulphate or chloride media[J]. Canadian Metallurgical Quarterly, 1987, 26(2): 91-101.
[33] PAKTUNC D, DUTRIZAC J E. Characterization of arsenate-for-sulfate substitution in synthetic jarosite using X-ray diffraction and X-ray absorption spectroscopy[J]. The Canadian Mineralogist, 2003, 41(4): 905-919.
[34] SHINODA K, TANNO T, FUJITA T, SUZUKI S. Coprecipitation of large scorodite particles from aqueous Fe(Ⅱ) and As (V) solution by oxygen injection[J]. Materials Transactions, 2009, 50(5): 1196-1201.
[35] WANG JD, LIU J K, LUO C X, LU Y, YANG X H. Silver phosphate crystal growth by screw dislocation driven of dynamic-template[J]. Crystal Growth Design, 2013, 13(11): 4837-4843.
[36] KASHCHIEV D, VEKILOV P G, KOLOMEISKY A B. Kinetics of two-step nucleation of crystals[J]. The Journal of Chemical Physics, 2005, 122(24): 244706-244711.
[37] VEKILOV P G. The two-step mechanism of nucleation of crystals in solution[J]. Nanoscale, 2010, 2(11): 2346-2357.
[38] DEBEKAUSSEN R, DROPPERT D, DEMOPOULOS G P. Ambient pressure hydrometallurgical conversion of arsenic trioxide to crystalline scorodite[J]. CIM Bulletin, 2001, 94(1051): 116-122.
[39] DEMOPOULOS G P, LAGNO F, WANG Q. The atmospheric scorodite process[C]//RIVEROS P A, DIXON D, DREISINGER D B, MENACHO J. Copper 2003, Santiago Chile: TMS Warrendale, 2003: 597-616.
Effect of supersaturation on morphology and stability of atmospheric pressure scorodite under As(Ⅴ)-Fe(Ⅱ) system
WANG Chang-yin, LI Min-ting, WEI Chang, LI Xing-bin, DENG Zhi-gan, LI Hui-yang, LEI Fu-guang
(Faculty of Metallurgical and Energy Engineering, Kunming University of Science and Technology, Kunming 650093, China)
Abstract: According to the problem that low solution supersaturation was the key factor in the process of scorodite synthesis under atmospheric pressure, the effect of pH on the oxidation rate of ferrous iron, the relationship between the oxidation rate of ferrous iron and supersaturation, and the effect of supersaturation on the precipitation percent of arsenic and iron, the content of scorodite components, particle size, morphology and stability were investigated in an As(Ⅴ)-Fe(Ⅱ) system by slow oxidation of ferrous ions. The results show that the oxidation rate of ferrous ions decreases with the decrease of initial pH value, while the supersaturation of solution decreases with the decrease of oxidation rate of ferrous ions. Lower initial supersaturation is not conducive to the precipitation of As and Fe, and has no significant influence on the content of arsenic and iron in the synthesized scorodite but has a greater impact on the sulfur content in synthesized scorodite. The initial supersaturation increases from 7.86 to 78.86, and the arsenic iron precipitation percent increases from 77.05% and 53.9% to 88.66% and 61.79%, respectively, and the contents of arsenic, iron and sulfur in the scorodite are 30.74%, 24.14% and 0.58%-0.17%, respectively. The particle size of scorodite first increases and then decreases with an increase of initial supersaturation. When the initial supersaturation is 11.7, the particle size reaches a maximum of 87.5μm. The initial supersaturation is in the range from 7.86 to 24, the spheroidoid particles are synthesized. The initial supersaturation is in the range from 24 to 78.86, it is irregular scorodite particles. By controlling the initial supersaturation in the range of 7.86-78.86, the stability of the synthesized scorodite is high, and its leaching toxicity is less than 1 mg/L.
Key words: scorodite; supersaturation; particle size; leaching toxicity
Foundation item: Projects(51964031, 51664038) supported by the National Natural Science Foundation of China; Project(2018M20172202044) supported by the Analysis Test Fund of Kunming University of Science and Technology, China
Received date: 2019-04-16; Accepted date: 2019-11-02
Corresponding author: LI Min-ting; Tel: +86-15987170155; E-mail: liminting@163.com
(编辑 何学锋)
基金项目:国家自然科学基金资助项目(51964031,51664038);昆明理工大学分析测试基金资助项目(2018M20172202044)
收稿日期:2019-04-16;修订日期:2019-11-02
通信作者:李旻廷,博士,副教授;电话:15987170155;E-mail:liminting@163.com
摘 要:针对低溶液过饱和度是常压臭葱石合成过程的关键要素这一问题,本文在As(Ⅴ)-Fe(Ⅱ)体系下,通过Fe2+缓慢氧化来控制溶液过饱和度,研究了pH对Fe2+氧化速率的影响、Fe2+氧化速率与过饱和度的关系和过饱和度对砷铁沉淀率、臭葱石组分含量、颗粒粒径、形貌及其稳定性的影响。结果表明,Fe2+的氧化速率随初始pH值的降低而降低,而溶液过饱和度随Fe2+氧化速率的降低而降低。较低的初始过饱和度不利于砷铁的沉淀,对渣中砷铁含量影响不显著,但对渣中硫含量影响较大。初始过饱和度从7.86升至78.86时,砷、铁沉淀率分别从77.05%、53.9%升至88.66%、61.79%,渣中砷、铁和硫含量分别为30.74%、24.14%和0.58%~0.17%。臭葱石颗粒粒径随初始过饱和度的增加而先增加后减小,初始过饱和度值为11.7时,颗粒尺寸达到最大87.5 μm。初始过饱和度为7.86~24时,形成类球型臭葱石颗粒;初始过饱和度值为24~78.86时,形成无规则型臭葱石颗粒。通过控制初始过饱和度在7.86~78.86下,合成的臭葱石稳定性高,其浸出毒性均小于1 mg/L。
[1] 沈 忱, 闵小波, 史美清, 周波生, 赵宗文, 李辕成, 张 纯. 砷滤饼的铜砷分离[J]. 中国有色金属学报, 2017, 27(2): 356-362.
[2] 易 宇, 石 靖, 田庆华, 郭学益. 高砷烟尘氢氧化钠-硫化钠碱性浸出脱砷[J]. 中国有色金属学报, 2015, 25(3): 806-814.
[4] 乔晋玺, 龙 双, 马雅琳, 邱 洋, 陈敬阳, 苗华磊, 陈爱良. 空气氧化碱浸含砷钴镍渣[J]. 中国有色金属学报,2018, 28(11): 2358-2365.
[6] VAHTER M. Mechanisms of arsenic biotransformation[J]. Toxicology, 2002, 181: 211-217.
[10] 刘辉利, 朱义年. CO2对砷酸钙稳定性影响的热力学分析[J]. 环境保护科学, 2006, 32(3): 7-10.
[12] 王化周. 镁盐污水脱砷的研究[J]. 大连工学院学报, 1980, 19(4): 83-92.
[13] 饶金元, 朱 云. 从含砷银矿浸出液中脱砷[J]. 中国钼业, 2008, 32(5): 22-24.
[14] 李 艺, 赖来仁. 臭葱石的初步矿物学研究[J]. 矿产与地质, 2003, 17(2): 170-172.
[17] 余自秀, 李存兄, 魏 昶, 樊 刚, 李兴彬, 邓志敢, 李旻廷. 砷铁水热共沉淀制备大颗粒臭葱石[J]. 过程工程学报, 2018, 18(1): 126-132.
[18] 张 俊, 李存兄, 魏 昶, 樊 刚 李兴彬, 邓志敢, 李旻廷, 张 鹏. 含砷废水水热法臭葱石沉砷[J].中国有色金属学报, 2019, 29(6): 1729-1288.
[22] 王宽岭. 臭葱石合成方法及稳定性研究[D]. 北京: 中国科学院大学, 2013: 45-68.
[25] 张 瑞. 结晶过程晶体形貌, 多维粒度和面生长动力学的在线实时测量[D]. 广州: 华南理工大学, 2016: 4-10.
[30] MERSMANN A. Crystallization technology handbook[M]. New York: Taylor Francis Inc, 2001: 832.


