文章编号:1004-0609(2016)-07-1568-08
功能化磁性载体固定耐辐射奇球菌及其对铀的吸附行为与机理
肖方竹1,何淑雅1,彭国文2, 3,唐 艳1,戴益民4
(1. 南华大学 生物化学与分子生物学国防支撑学科实验室,衡阳 421001;
2. 南华大学 化学化工学院,衡阳 421001;
3. 中南大学 资源与安全工程学院,长沙 410083;
4. 长沙理工大学 化学与生物工程学字院,电力与交通材料保护湖南省重点实验室,长沙 410004)
摘 要:为了解决耐辐射奇球菌(DR)容易以悬浮态生长,菌体与水的密度差较小,吸附铀后难以分离等问题,首先使用氯化亚砜对羧基化磁性纳米Fe3O4粒子进行酰氯功能化,以此作为DR菌固定载体,再与二乙烯三胺化学修饰的DR菌进行固定化,得到一种新型功能化磁性耐辐射奇球菌吸附剂NFGDR,并通过红外光谱仪和扫描电镜分别表征吸附剂NFGDR的结构。考察溶液pH值、吸附时间、铀初始浓度和吸附剂投加量等因素对吸附剂NFGDR吸附铀的影响,对吸附动力学模型和吸附等温模型进行分析。结果表明:吸附剂NFGDR表面具有大量吸附铀的基团,吸附铀后表面形态发生变化;吸附铀的最佳条件是pH值为5、吸附时间为80 min、铀初始浓度为10 mg/L和吸附剂投加量为5 mg。吸附剂NFGDR对铀的吸附动力学过程符合准二级动力学模型, 吸附等温线符合Langmuir等温线模型,说明该吸附体系是一个单层吸附过程。同时,使用3种不同的解析剂对吸附剂NFGDR解析再生6次后,其对铀的吸附率均在80%以上,说明其具有良好的再生性能。
关键词:功能化;磁性载体;耐辐射奇球菌;铀;吸附机理
中图分类号:X172 文献标志码:A
根据核军工的战略需求和核电的发展规划,为了满足核军工和核电对天然铀的日益增长需求,我国仍将加大铀矿开采和选冶的力度,与此同时,在铀矿开采和选冶过程中产生的含铀废水也会日益增多[1]。这些排放的含铀废水如果没有得到妥善处理,进入生态环境后将改变其环境本底辐射而致使物种基因畸变,对人类生态环境造成一定的威胁[2-6]。因此,如何有效处理铀矿冶含铀废水是当前铀矿冶领域亟待解决的核心科技问题[7-8]。
与传统的物理-化学法相比,生物修复法具有效率高、成本低、耗能少、无二次污染物等优点,吸引了众多学者进行了大量研究,并取得了很多可喜的研究成果[9-11]。但是,很多生物在修复铀矿冶含铀废水时,由于其对辐射比较敏感,很难在长期核辐射环境下生存,因此它们修复含铀废水的能力受到较大限制。
耐辐射奇球菌(Deinococcus radiodurans,DR菌)是迄今为止地球上发现的辐射抗性最强的生物,能够在60 Gy/h的环境中正常生长并不出现致死或发生诱变,从而倍受核环境工程界的广泛关注和重视[12-13]。然而,DR菌在含铀废水中容易以悬浮态生长,菌体与水的密度差较小,吸附铀后难以分离,耐冲击性差等因素,导致其修复铀矿冶含铀废水的实际效果不太理想。如果使用功能化磁性纳米Fe3O4粒子作为DR菌固定载体,采用物理或者化学方法将DR菌固定在特定介质空间内,并使其具有较好的力学强度和化学稳定性能,且能多次循环使用,那么这一技术将有望解决上述问题。
本文作者首先使用氯化亚砜对羧基化磁性纳米Fe3O4粒子进行酰氯功能化,以此作为DR菌固定载体,再与二乙烯三胺化学修饰的DR菌进行固定化,得到一种新型功能化磁性耐辐射奇球菌吸附剂NFGDR,以其作为铀吸附材料,通过静态吸附-解吸实验研究了吸附剂NFGDR对铀的吸附-解吸行为与机理,系统考察了溶液的pH值、吸附时间、铀初始浓度和吸附剂投加量等主要因素对吸附剂NFGDR吸附铀的影响,建立了相应的动力学和吸附热力学模型。
1 实验
1.1 实验菌株、培养基、主要试剂与仪器
耐辐射奇球菌Deinococcus radiodurans R1,购自中国普通微生物菌种保藏管理中心(CGMCC),编号1.633,保存在本实验室。
TGY固体培养基:胰蛋白胨5 g/L,酵母提取物3 g/L,葡萄糖1 g/L,琼脂15 g/L,pH= 7。TGY液体培养基除不加琼脂外,其余成分与固体培养基相同。
主要试剂:戊二醛、无水乙醇、氨水、二乙烯三胺溶液、N,N-二甲基甲酰胺、油酸、氯化亚砜为化学纯,其余均为分析纯。铀标准溶液采用文献[4]方法配制,再根据实验需要稀释成对应浓度。
主要仪器:IR Prestige-21型傅里叶变换红外光谱仪(日本岛津公司生产),JSM-6360LV型扫描电子显微镜(日本电子公司生产)。
1.2 吸附剂NFGDR的制备
1.2.1 酰氯功能化磁性纳米Fe3O4粒子
称取50 g磁性纳米Fe3O4粒子加入500 mL三口烧瓶中,分别加入100 mL去离子水和50 mL 0.001 mol/L稀HCl溶液,超声分散0.5 h后,将三口烧瓶放在60 ℃ 恒温水浴箱中磁力搅拌2.0 h(N2保护),并使用0.001 mol/L稀HCl溶液调节体系pH值为4.0,从而使磁性纳米Fe3O4粒子充分活化。再将其装入烧杯置于120 ℃烘箱中8.0 h,除去其表面的水分,并取出置于干燥器中备用。
称取10 g活化后的磁性纳米Fe3O4粒子,装入500 mL三口烧瓶中,加入150 mL N,N-二甲基甲酰胺溶液进行超声分散1.0 h,并使用浓度为25%的氨水调节溶液的pH值为6.0。然后向三口烧瓶中逐滴加入4.5 g油酸,将三口烧瓶放在70 ℃油浴中加热回流5.0 h,从而使纳米Fe3O4粒子羧基化。再加入45 mL氯化亚砜,随后在85 ℃油浴中继续加热回流2.0 h,得到酰氯功能化的磁性纳米Fe3O4粒子。
1.2.2 化学修饰DR菌
首先将保存在本实验室的DR菌进行活化培养,即使用接种环挑取DR菌在预先配制好的固体TGY培养基上进行划平板,将划好的平板整体移入30 ℃的恒温振荡培养箱(220 r/min)中培养48 h。随后使用接种环挑取活化培养的DR菌体至的装有液体TGY培养基的EP管中,并将接种好的EP管移至30 ℃的恒温振荡培养箱(220 r/min)中扩大培养72 h。待TGY培养基长满菌丝后,将EP管取出,离心收集DR菌体(8000 r/min,10 min),用去离子水洗净(3次),将DR菌体于55 ℃的烘箱中烘干24 h,冷却后使用粉碎机研磨并过106 μm孔径的标准筛,收集106 μm以下的DR菌体,并将干DR菌体保存在干燥器中备用。
称取5.0 mg干燥的DR菌体于250 mL的锥形瓶中,加入50 mL去离子水,再加10 mL 50% 戊二醛溶液,使DR菌体充分溶解,继续加入35 mL二乙烯三胺,于30 ℃恒温水浴摇床内振荡反应60 h。收集产物后,依次使用去离子水和无水乙醇洗涤2次,离心收集(8000 r/min,15 min),在45 ℃下真空干燥12 h,得到二乙烯三胺修饰DR菌(简称化学修饰DR菌)。
1.2.3 功能化磁性载体固定DR菌
将1.0 g酰氯功能化磁性纳米Fe3O4粒子装入500 mL的烧杯中,加入100 mL去离子水,室温下超声分散1.5 h后,使用0.1mol/L 的HCl溶液和NaOH溶液调节体系pH 值为6.0。再向烧杯中加入3.0 mg二乙烯三胺修饰DR菌,随后加入50 mL无水乙醇和质量浓度为35% 浓盐酸进行超声分散,使其均匀分散在酰氯功能化磁性纳米Fe3O4粒子的悬浮液中。然后将烧杯置于70 ℃的恒温水浴箱中磁力搅拌3.0 h,随后使之静止沉降,取上清液,经离心(8000 r/min,15 min)后,再分别用无水乙醇和去离子水洗涤3 次,75 ℃真空干燥2.5 h,即得到一种新型功能化磁性耐辐射奇球菌吸附剂NFGDR。
1.3 吸附剂NFGDR对铀的吸附-解吸实验
使用容量瓶准确移取100 mL一定浓度的铀标准溶液于250 mL具塞锥形瓶中,使用0.1mol/L 的HCl溶液和NaOH溶液调节体系pH 值,根据实验需要,称取一定质量的吸附剂NFGDR加入上述锥形瓶中(每组设置3个平行样),将其置于25 ℃恒温水浴箱中进行振荡吸附一定时间后,离心分离,取上清液,使用三氯化钛还原/钒酸铵氧化滴定法测定铀的剩余浓度,并根据吸附前后溶液中铀的浓度,从而计算出吸附剂的单位吸附量q (mg/g)和铀的吸附率p(%)。
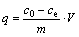 (1)
(1)
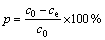 (2)
(2)
式中:c0为吸附前铀的质量浓度,mg/L;ce为t时刻铀的剩余质量浓度,mg/L;m为吸附剂NFGDR的质量,g;V为溶液体积,mL。
上述吸附达到平衡后的吸附剂NFGDR与溶液离心分离后,向其中分别加入一定量的HCl、NaHCO3和EDTA等解吸剂溶液,25 ℃恒温振荡2 h后过滤,测定滤液中铀的浓度。然后使用去离子水将解吸后的吸附剂NFGDR反复洗至中性、供干,再将再生后的吸附剂NFGDR循环使用6次,分别计算解吸下来的铀的容量qd(mg/g)和解吸率pd(%):
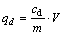 (3)
(3)
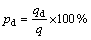 (4)
(4)
式中:cd为解析液中铀的质量浓度,mg/L;V为解析液的体积,mL;m为吸附剂NFGDR的质量,g。
2 结果与讨论
2.1 吸附剂NFGDR对铀吸附效果的影响因素分析
2.1.1 溶液 pH 值对铀的吸附效果影响
在100 mL铀初始浓度为10 mg/L的溶液中投加5 mg的吸附剂NFGDR,在25 ℃恒温水浴箱中振荡吸附80 min后,溶液pH值对铀的吸附效果影响的实验结果见图1。
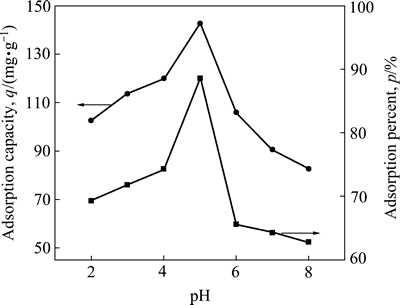
图1 溶液pH值对铀的吸附效果
Fig. 1 Effect of pH on uranium adsorption efficiency by NFGDR
从图1可以看出,溶液 pH 对铀的吸附效果影响较大。当溶液 pH值为2时,吸附剂NFGDR对铀的吸附率只有67.82%;随着溶液 pH值增大,吸附剂NFGDR对铀的吸附率也在增大,当溶液pH值为5时达到最大值,吸附率高达90.32%,对应的单位吸附量为149.96 mg/g。这是由于当溶液pH值较小时,溶液中大量存在的H3O+和H+极易与水溶液中UO22+发生竞争吸附,而且大量存在的H+容易使吸附剂NFGDR表面的活性基团被质子化,对UO22+产生静电斥力,因而吸附率较低。随着溶液pH 值的升高,吸附剂NFGDR表面逐渐暴露出大量活性基团(如—OH,—COOH和—NH2等基团),这些基团上的氢键容易丢失,表现出较强的电负性,增强了其与UO22+之间的结合能力和反应几率,吸附率就增大。但是,继续提高溶液pH值,当pH值大于7时,吸附率又逐渐下降。这是由于溶液中的UO22+发生水解,形成复杂的水解产物,不利于吸附剂NFGDR 对铀的吸附作用[14]。因此吸附剂NFGDR吸附铀的最佳溶液pH值为5。
2.1.2 吸附时间对铀的吸附效果影响
在100 mL铀初始浓度为10 mg/L的溶液中投加5 mg的吸附剂NFGDR,调节溶液pH为5,在25 ℃恒温水浴箱中振荡吸附,吸附时间对铀的吸附效果的影响实验结果见图2。
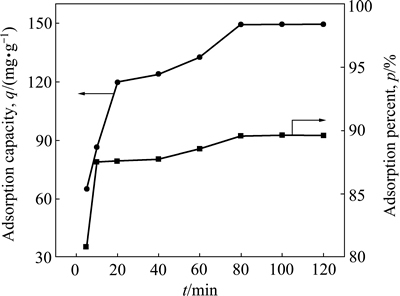
图2 吸附时间对铀的吸附效果影响
Fig. 2 Effect of time on uranium adsorption efficiency by NFGDR
由图2可以看出,吸附剂NFGDR对铀的吸附速率较快,在80 min后吸附几乎达到吸附平衡,单位吸附量和吸附率分别为151.02 mg/g和90.69%。在吸附开始阶段吸附剂NFGDR对铀的吸附速率和吸附容量随时间的增加而增加,而后期吸附曲线趋于平稳。这是由于在吸附初期吸附剂NFGDR表面含有大量的吸附空位,且溶液中的UO22+较多,因此,吸附速率较快。而后期吸附剂NFGDR表面的吸附位点逐渐被占据,对铀的吸附逐渐达到饱和而趋于平衡。
2.1.3 铀初始浓度对铀的吸附效果影响
在100 mL一定浓度的铀标准溶液中投加5 mg的吸附剂NFGDR,调节溶液pH为5,在25 ℃恒温水浴箱中振荡吸附80 min后,铀初始浓度对铀的吸附效果的影响实验结果见图3。
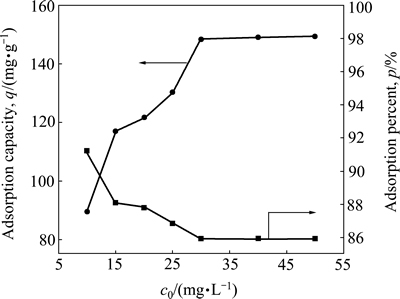
图3 铀初始浓度对铀的吸附效果影响
Fig. 3 Effect of uranium initial concentration on uranium adsorption efficiency by NFGDR
由图3可以看出,随着铀初始浓度的增加,吸附剂NFGDR对铀的吸附率反而减小。这是由于在溶液中添加相同质量的吸附剂NFGDR,其提供的可吸附的吸附位点就有限,当吸附达到平衡时,吸附位点也达到饱和,此时铀初始浓度再提高,吸附剂NFGDR对铀的吸附率则降低。另外,由于铀浓度较高时,含铀废水可能会导致吸附剂NFGDR细胞壁结构破坏,从而导致有效吸附位点减少,这也是吸附率降低的原因之一。
然而,吸附剂NFGDR对铀的单位吸附量与对铀的吸附率呈相反的变化趋势,这是由于随着UO22+浓度的增加,溶液提供的UO22+数量不断增多,而且不断聚集在吸附剂NFGDR的表面和空隙中,形成一种吸附推动力,从而吸附量不断增加。当溶液中铀的浓度超过30 mg/L时,由于吸附剂NFGDR表面基团基本已达饱和吸附状态,单位吸附量不会随着铀浓度的升高而显著增大[15]。
2.1.4 吸附剂投加量对铀的吸附效果影响
在铀初始浓度为10 mg/L的溶液中投加一定质量的吸附剂NFGDR,调节溶液pH为5,在25 ℃恒温水浴箱中振荡吸附80 min后,吸附剂NFGDR投加量对铀的吸附效果的影响实验结果见图4。
由图4可见,吸附剂NFGDR投加量对铀的吸附效果的影响与铀初始浓度的影响趋势恰好相反。随着吸附剂NFGDR投加量的增大,其对铀的吸附率增大,但对铀的单位吸附量却不断减少。这是因为吸附剂NFGDR投加量的增加使其与溶液中铀酰离子的接触面积也增大,吸附位点和参与吸附的官能团的数量也增多,从而促使铀的吸附率上升。但是,当吸附剂NFGDR达到吸附平衡后,再增加其投加量,其对铀的单位吸附量反而减少。当吸附剂NFGDR投加量为5 mg时,其对铀的吸附率和单位吸附量分别为90.93%和146.37 mg/g。
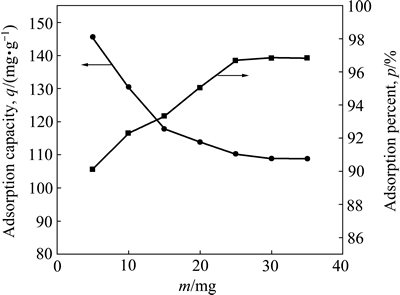
图4 吸附剂用量对铀吸附效果的影响
Fig. 4 Effect of adsorbent dosage on uranium adsorption efficiency by NFGDR
2.2 吸附剂NFGDR对铀的吸附-解吸行为分析
2.2.1 吸附剂NFGDR对铀的吸附动力学
为了进一步研究吸附剂NFGDR对铀的吸附动力学行为,采用准一级反应动力学模型和准二级反应动力学模型对2.1.2节实验结果进行拟合分析,拟合结果见表1。
表1 吸附剂NFGDR吸附铀的动力学参数
Table 1 Kinetic parameters of uranium adsorption by NFGDR

从表1的拟合结果来看,准一级反应动力学和准二级反应动力学模型的相关系数 R12和R22分别为0.9126和0.9903,准二级反应动力学模型得到的平衡吸附量为155.89 mg/g,与2.1.2节实验所得的饱和吸附量151.02 mg/g比较接近,说明使用准二级反应动力学模型可以更好地描述吸附剂NFGDR对铀的吸附行为。根据准二级反应动力学模型建立机理,可以推测吸附剂NFGDR在吸附铀的过程中主要受化学作用控制,质量扩散对其吸附速率的影响基本可以忽略[16]。
2.2.2 吸附剂NFGDR对铀的吸附等温线
吸附等温线描述的是在一定温度下吸附剂对重金属离子的平衡吸附量与平衡浓度之间的变化关系。采用常用的Langmuir和Freundlich吸附等温线对2.1.3节实验结果进行拟合分析,拟合结果见表2。
表2 NFGRD吸附铀的等温线参数
Table 2 Kinetic parameters of uranium adsorption by NFGDR
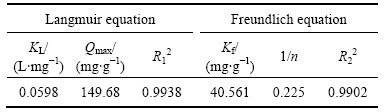
从表2的拟合结果来看,Langmuir和Freundlich吸附等温模型均能较好地描 述吸附剂NFGDR对铀的吸附行为,Langmuir和Freundlich吸附等温模型的相关系数 R12和R22分别为0.9938和0.9902,说明Langmuir吸附等温模型的拟合程度高于Freundlich吸附等温模型,这主要是由于吸附剂NFGDR对铀的吸附发生在吸附剂NFGDR表面的活性区位,属于均一的单分子层吸附单层吸附且离子间无相互作用[17]。在Langmuir吸附等温模型中,一般认为KL在 0~1 范围内,吸附反应容易进行。在Freundlich 等温线模型中,1/ n 值小于0.5,说明吸附剂NFGDR对铀的吸附是自发的。
2.2.3 吸附剂NFGDR对铀的解吸行为
分别采用0.1mol/L的HCl、NaHCO3和EDTA溶液对达到吸附平衡的吸附剂NFGDR进行解吸,然后使用去离子水将解吸后的吸附剂NFGDR反复洗至中性、供干。再将再生后的吸附剂NFGDR循环使用6次,分别计算解吸率pd(%),实验结果见表3。
由表3结果显示,达到吸附平衡后的吸附剂NFGDR分别采用0.1 mol/L的HCl、NaHCO3和EDTA溶液解析再生6次后,铀的吸附率减少不多,吸附能力降低不大,均保持在80%以上,说明吸附剂NFGDR具有良好的再生性能,在实际含铀废水处理应用中可以多次重复利用,也可大大节省吸附剂的使用量,做到节能环保。
2.3 吸附剂NFGDR对铀的吸附机理分析
2.3.1 红外光谱(FTIR)分析
图5所示为吸附剂NFGDR与初始浓度为10 mg/L的铀溶液,pH值为5,在25 ℃条件下作用前后FTIR谱。其中,3589.59 cm-1左右存在一个强而宽的谱带,该处为 O—H 对应的伸缩振动吸收峰,2938.53 cm-1是C—H伸缩振动吸收峰,1756.35 cm-1和1436.48 cm-1分别可以归属为酰胺I带特征吸收峰和耐辐射奇球菌中肽键中的C—N键的伸缩振动峰,1056.53 cm-1附近的吸收峰主要来自于耐辐射奇球菌中C—C、C—O和C—O—C键的吸收峰。605.13 cm-1和529.25cm-1为 PO43-的面外弯曲振动峰[18]。由此可以推断,吸附剂NFGDR表面含有较多的氨基、羟基、羧基、磷酸基等活性基团。从吸附剂NFGDR吸附铀后的 FTIR 光谱图可以看出,O—H和C—H伸缩振动峰基本未变,酰胺Ⅰ带特征吸收峰和C—N键的伸缩振动峰在与铀作用后分别向左和右移动了4 cm-1和 2 cm-1,说明吸附剂NFGDR对铀产生了吸附作用。另外,在2249.52 cm-1处曲线(b)比曲线(a)多出较明显的吸收峰,可能是酰氯功能化的磁性纳米Fe3O4粒子固定化学修饰后的DR菌体后所表达出来的特征吸收峰。
2.3.2 扫面电镜(SEM)分析
图6所示为吸附剂NFGDR吸附铀前后 SEM像。图6中是放大50 000倍后的表面形态。从图6(a)可以看出,吸附剂NFGDR在吸附铀前的表面非常粗糙不平,形状不规则,这种状态比较有利于吸附过程的进行,为吸附铀提供了较大的表面积和更多的吸附位点。由图6(b)可看出,吸附剂NFGDR吸附铀后,表面变得更加的致密,使得其形态变得比吸附前平整些,空隙明显减少,且仍存在一定的团聚现象,这表明吸附剂NFGDR吸附了一定量的铀,且吸附剂NFGDR表面的功能基团参与对铀的吸附作用,说明存在化学吸附。
表3 NFGRD吸附铀的解吸实验结果
Table 3 Results of uranium desorption experiments by NFGDR
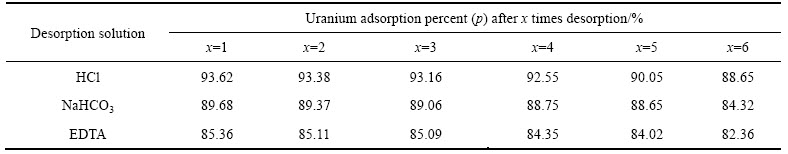
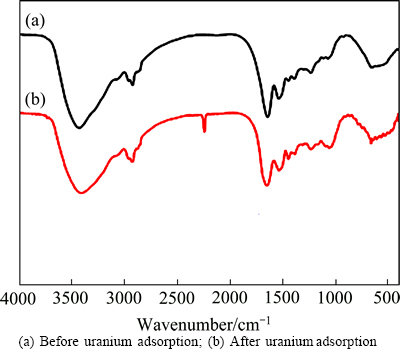
图5 吸附剂NFGDR吸附铀前后的FTIR像
Fig. 5 FTIR spectra for NFGDR before and after adsorption of uranium:
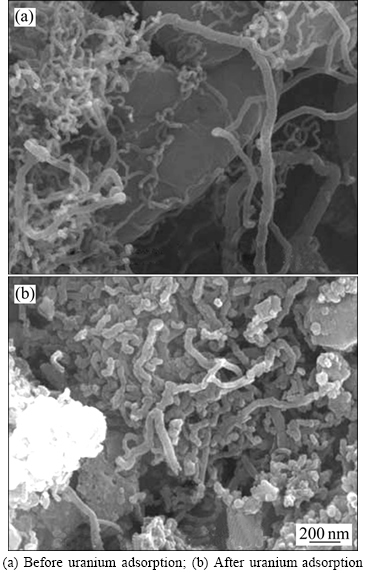
图6 吸附剂NFGDR吸附铀前后的SEM像
Fig. 6 SEM images for NFGDR before and after adsorption of uranium:
3 结论
1) 吸附剂NFGDR对铀具有较好的吸附效果。NFGDR吸附铀的最佳条件是:pH 值为 5,吸附时间为80 min,铀初始浓度为10 mg/ L以及吸附剂NFGDR投加量为5 mg。
2) 吸附剂NFGDR吸附铀的动力学研究表明,吸附铀过程可以采用准二级反应动力学模型进行描述,这将可推测FCMMC吸附铀的过程主要是化学吸附过程。
3) 吸附剂NFGDR吸附铀的行为符合 Langmuir 吸附等温模型,这就体现了吸附剂表面的吸附位点均匀分布且对铀酰离子具有相同的亲和力,属于单层吸附过程。
4) 吸附剂NFGDR具有较好的再生性能,对达到吸附平衡后的吸附剂NFGDR使用3种不同的解析剂解析再生6次后,对铀的吸附率均在80%以上。
5) 通过对吸附剂NFGDR吸附铀前后的红外光谱和扫描电镜分析,发现吸附剂NFGDR为吸附铀提供了较大的表面积和更多的吸附位点,而且吸附一定量的铀而发生表面形态的变化,表明吸附剂NFGDR对铀的吸附效果明显。
REFERENCES
[1] 彭国文. 新型功能化吸附剂的制备及其吸附铀的试验研究[D]. 长沙: 中南大学, 2014: 3-4.
PENG Guo-wen. Preparation of novel functional adsorbents and studies on uranium adsorption experiment[D]. Changsha: Central South University, 2014: 3-4.
[2] PENG Guo-wen, DING De-xin, XIAO Fang-zhu, WANG Xiao-liang, HU Nan, WANG Yong-dong, DAI Yi-min, CAO Zhong. Adsorption of uranium ions from aqueous solution by aminegroup functionalized magnetic Fe3O4 nanoparticle[J]. Journal of Radioanalytical and Nuclear Chemistry, 2014, 301: 781-788.
[3] WANG Xiao-liang, PENG Guo-wen, YANG Yan, WANG Yang-fei, HE Ting-ting. Uranium adsorption by dry and wet immobilized Saccharomyces cerevisiae[J]. Journal of Radioanalytical and Nuclear Chemistry, 2012, 291: 825-830.
[4] 彭国文, 丁德馨, 胡 南, 杨雨山, 王晓亮. 纳米Fe3O4负载啤酒酵母菌对铀的吸附性能与机理[J]. 中国有色金属学报, 2012, 22(2): 604-610.
PENG Guo-wen, DING De-xin, HU Nan, YANG Yu-shan, WANG Xiao-liang. Adsorption properties and mechanism of saccharomyces cerevisiae loaded by Nano-Fe3O4 on uranium[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(2): 604-610.
[5] 彭国文, 丁德馨, 胡 南, 杨雨山, 王晓亮. 化学修饰啤酒酵母菌对铀的吸附特性[J]. 化工学报, 2011, 62(11): 3201-3206.
PENG Guo-wen, DING De-xin, HU Nan, YANG Yu-shan, WANG Xiao-liang. Kinetics model of Uranium adsorption by saccharomyces cerevisiae with chemical modification[J]. CIESC J, 2011, 62(11): 3201-3206.
[6] KHANI M H, KESHTKAR A R, GHANNADI M, PAHLAVANZADEH H. Equilibrium, kinetic and thermodynamic study of the biosorption of ur anium onto Cystoseria indica algae[J]. Journal of Hazardous Materials, 2014, 150(3): 612-618.
[7] GHASEMI M, KESHTKAR A R, DABBAGH R, SAFDARI S J. Bioadsorption of uranium (Ⅵ) from aqueous solutions by Ca-pretreated Cystoseira indica alga: Breakthrough curves studies and modeling[J]. Journal of Hazardous Materials, 2015, 189: 141-149.
[8] ZHANG Hong-sheng, WANG Jun, ZHANG Bin, LIU Qi, LI Song-nan, YAN Hui-jun, LIU Lian-he. Synthesis of a hydrotalcite like compound from oil shale ash and its application in uranium removal[J]. Colloids and Surfaces A, 2014 , 444: 129-137.
[9] KHANI M H, KESHTKAR A R, GHANNADI M, PAHLAVANZADEH H. Equilibrium, kinetic and thermodynamic study of the biosorption of ur anium onto Cystoseria indica algae[J]. Journal of Hazardous Materials, 2014, 150(3): 612-618.
[10] WANG Jin-song, HU Xin-jiang, WANG Jie, BAO Zheng-lei, XIE Shui-bo, YANG Jin-hui. The tolerance of Rhizopus arrihizus to U(Ⅵ) and biosorption behavior of U(VI) onto R. arrihizus[J]. Biochemical Engineering Journal, 2010, 51: 19-23.
[11] XIE Shui-bo, ZHANG Chun, ZHOU Xing-huo, YANG Jing, ZHANG Xiao-jian, WANG Jing-song. Removal of uranium (Ⅵ) from aqueous solution by adsorption of hematite[J]. Journal of Environmental Radioactivity, 2009, 100: 162-166.
[12] BRIM H, MCFARLAN S C, FREDRICKSON J K, MINTON K W, ZHAI M, WACKETT L P, DALY M J. Engineering Deinococcus radiodurans for metal remediation in radioactive mixed waste environments[J]. Nature Biotechnology, 2000, 18(1): 85-90.
[13] RAINEY F A, RAY K, FERREIRA M, GATZ B Z, NOBRE M F, BAGALEY D, RASH B A, PARK M J, EARL A M. Extensive diversity of ionizing-radiation-resistant bacteria recovered from Sonoran Desert soil and description of nine new species of the genus Deinococcus obtained from a single soil sample[J]. Applied and Environmental Microbiology, 2005, 71(9): 5225-5235.
[14] BARNETT M O, JARDINE P M, BROOKS S C. Adsorption and transport of uranium (Ⅳ) subsurface media[J]. Soil Sci Soc Am J, 2000, 64(3): 908-917.
[15] WANG Jing-song, HU Xin-jiang, LIU Yun-guo, XIE Shui-bo, BAO Zheng-lei. Biosorption of uranium (Ⅵ) by immobilized Aspergillus fumigatus beads[J]. Journal of Environmental Radioactivity, 2010, 101: 504-508.
[16] KUMAR Y P, KING P, PRASAD V S R K. Equilibrium and kinetic studies for the biosorption system of copper(Ⅱ) ion from aqueous solution using Tectona grandis L. f. leaves powder[J]. Journal of Hazardous Materials, 2006, 137(2): 1211-1217.
[17] DEEPTHI R R, SASIDHAR P. Sorption of cesium on clay colloids: kenetic and thermodynamic studies[J]. Aqut Geochem, 2012, 18(4): 281-296.
[18] KUSHWAHA S, SREEDHAR B, PADMAJA P. XPS, EXAFS, and FTIR as tools to probe the unexpected adsorption coupled reduction of U(Ⅵ) to U(Ⅴ)and U(Ⅳ)on Borassus flabellifer based adsorbents[J]. Langmuir, 2012, 28: 16038-16048.
Adsorption behavior and mechanism of uranium (Ⅵ) on Deinococcus radiodurans immobilized functionalization magnetic carrier
XIAO Fang-zhu1, HE Shu-ya1, PENG Guo-wen2, 3, TAN Yan1, DAI Yi-min4
(1. Support Discipline Laboratory of National Defence for Biochemistry and Molecular biology,
University of South China, Hengyang 421001, China;
2. School of Chemistry and Chemical Engineering, University of South China, Hengyang 421001, China;
3. School of Resources and Safety Engineering, Central South University, Changsha 410083, China;
4. The Key Laboratory of Powder and Transport Materials Protection in Hunan Province, College of Chemistry and Chemical Engineering, Changsha University of Science & Technology, Changsha 410004, China)
Abstract: In order to solve the problems such as Deinococcus radiodurans (DR) growing in a suspended state, the small difference between the bacteria density and the water density, and the hard separation after uranium adsorption, the novel functional magnetic Deinococcus radiodurans adsorbent NFGDR was prepared. At first, the carboxylation magnetic Fe3O4 nanoparticle was chloride functionalization using sulfoxide chloride, and it was immobilized with the chemical modification DR using Diethylenetriamine as the magnetic carrier. FT-IR and SEM were used to characterize NFGDR, and the effects of pH value, adsorption time, initial concentration of uranium and the adsorbent dosage on the adsorption of NFGDR on uranium were investigated. The adsorption kinetic models and the adsorption isotherm models of NFGDR on uranium were studied. The results show that a lot of functional groups are found on the cell wall of NFGDR for adsorbing uranium , and its surface form changes because of adsorbing uranium. The optimal uranium adsorption conditions are as follows: the pH of the solution is 5; the adsorption time is 80 min; the initial concentration of uranium is 10 mg/L and the adsorbent dosage is 5 mg. The kinetic model of NFGDR can be described by the pseudo-second-order model well, and the isotherm model is fitted to Langmuir adsorption model, indicating that the adsorption process is a monolayer cover adsorption process. At the same time, the uranium adsorption percents are over 80% after NFGDR was regenerated 6 times using 3 different analytical agents. It shows that NFGDR has good regeneration performance.
Key words: functionalization; magnetic carrier; Deinococcus radiodurans; uranium; adsorption mechanism
Foundation item: Projects(51574152, 11205084, 81272993) supported by the National Natural Science Foundation of China; Project(2014GK3079) supported by the Foundation of Hunan Province Science and Technology Department, China; Project(2016CL03) supported by the Hunan Provincial Key Laboratory of Materials Protection for Electric Power and Transportation, China
Received date: 2015-08-25; Accepted date: 2016-01-07
Corresponding author: PENG Guo-wen; Tel: +86-15874720055; E-mail: pgwnh@sohu.com
(编辑 王 超)
基金项目:国家自然科学基金资助项目(51574152,11205084,81272993);湖南省科技厅项目(2014GK3079);长沙理工大学电力与交通材料保护湖南省重点实验室开放基金资助项目(2016CL03)
收稿日期:2015-08-25;修订日期:2016-01-07
通信作者:彭国文, 副教授,博士;电话:15874720055;E-mail: pgwnh@sohu.com