钛催化氢化铝钠的贮氢性能
王同涛, 王树茂, 黄 卓, 蒋利军, 刘晓鹏
(北京有色金属研究总院 能源材料与技术研究中心, 北京 100088)
摘 要: 通过加入钛系、 锆系催化剂以及碳等添加剂可以显著改善配位氢化物的吸放氢动力学性能, 加入催化剂可以使配位氢化物的可逆贮氢量达3.1%~4.2%(质量分数)。 采用机械合金化法在NaAlH4中加入钛的化合物作为催化剂, 在很大程度上改进了其热力学和动力学性能, 可逆吸氢量可达4.0%以上, 可逆放氢量也能达3.0%以上。 并对试样进行了X射线衍射、 扫描电镜以及X射线光电子能谱分析, 证明了可逆反应的发生, 探讨反应的机理。
关键词: 氢化铝钠; 贮氢材料; 机械合金化 中图分类号: TG139
文献标识码: A
Hydrogen storage properties of catalyzed sodium alanates
WANG Tong-tao, WANG Shu-mao, HUANG Zhuo, JIANG Li-jun, LIU Xiao-peng
(Research Center of Energy Material and Technology,General Research Institute for Non-ferrous Metals, Beijing 100088, China)
Abstract: The discovery that hydrogen can be reversibly absorbed and desorbed from complex hydrides (alanates) by the addition of catalysts has created an entirely new prospect for lightweight hydrogen storage. Unlike the intermetallic hydrides, these compounds release hydrogen through a series of decomposition/recombination reactions. The reversible capacity of these materials can reach 3.1%-4.2%(mass fraction) by addition of catalysts. The kinetics of dehydrogenation and rehydrogenation of the alanates was greatly improved by doping catalysts including Ti, Zr, Fe and additives such as C. The study on sodium aluminium hydride doping with Ti-compound by mechanical milling was shown. The thermodynamics and kinetics are enhanced greatly and its reversible capacity of hydrogen reaches 3.0%. The phase structure and valence change were characterized by X-ray diffractrometry (XRD), scanning electron microscopy (SEM) and X-ray photoelectron spectroscopy (XPS).
Key words: sodium aluminium hydride; hydrogen storage material; mechanical milling
在不远的将来, 汽车工业将引入氢能驱动的燃料电池车[1]。 而这种燃料电池车产业化和实用化的条件之一就是需要安全、 轻质和高密度的车载氢源。 众所周知, 液氢、 压缩氢气等方法都有其本身难以克服的缺点[2]。 现今研究开发比较成熟的固态贮氢方法—金属氢化物贮氢[2-4], 目前虽已广泛用于氢的贮存和运输、 氢同位素分离、 温度和压力传感器、 有机化合物氢化反应的催化剂和镍氢电池等领域, 然而, 传统的贮氢合金AB5、 AB2和AB型贮氢合金的贮氢量均不超过2%(质量分数)。 这对于应用于某些领域(如燃料电池) 是远远不够的。 因此, 贮氢材料的研究和开发转向高容量材料的研究。 配位氢化物就是一种高贮氢量、 轻质量的氢化物, 且能在较温和的条件下放氢。 配位氢化物NaAlH4放氢的主要反应机理为以下两步反应:
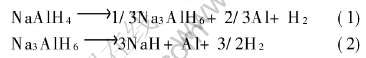
其中NaH分解条件比较苛刻, 分解温度高达400~500℃, 不宜作为可逆的氢气源。 从化学计量数计算, 上述反应中的第一步有3.7%的氢气放出, 第二步则有1.9%, 该反应理论上有5.6%的可逆氢贮量。
这种材料对于可逆氢化物来说, 其热力学性能相当的出众。 但问题是该材料在150℃以下吸放氢的动力学性能极其缓慢。 长期以来人们都认为该反应是不可逆的, 从而无法应用于氢的贮存[5, 6]。 1997年, Bogdanovic等[7]通过加入含钛的催化剂后使反应(1)和(2)的动力学大为改观, 从而激发了人们对配位氢化物的研究兴趣。 研究发现, 通过加入钛系、 锆系催化剂以及碳等添加剂可以显著改善配位氢化物的吸放氢动力学性能, 可以使配位氢化物的可逆贮氢量达3.1%~4.2%[8-11]。
本文作者采用机械合金化法在络合氢化物氢化铝钠(NaAlH4)中加入钛基催化剂, 改进了其热力学和动力学性能, 使其接近燃料电池的使用要求。
1 实验
采用市售氢化铝钠(95%), 为了避免和氧气以及水气接触而发生反应, 所有的操作都在氩气保护的手套箱中进行。 制取试样方法是: 在NaAlH4中添加2%(摩尔分数)的Ti化合物, 以SPEX8000球磨机高能球磨4h, 球料质量比为10∶1。
制备的试样用PCT(Pressure-Composition-Temperature)实验台测试其吸放氢性能。 试样的结构和相分析采用XD-2型X射线衍射仪进行X射线衍射(XRD)测试。 XRD测试的扫描范围是15°到90°, 扫描速率为2(°)/min, 铜靶Kα辐射。 应用HITACHI S4800场发射扫描电子显微镜和能谱分析系统对粉末样品的形貌和成分分布进行分析。 所用扫描电镜空间分辨率3.5nm, 加速电压30kV。 应用英国VG公司的MKⅡ-X射线光电子能谱仪对粉末样品中催化剂的价态进行分析。 X射线光源: Mg Kα1253.6eV, 通过能: 50eV。
2 结果与分析
2.1 物相与形貌分析
图1所示为NaAlH4通过高能球磨加入2%钛化合物作为催化剂后放氢以及吸氢后的X射线衍射谱。 图1(a)所示为该试样放氢后的X射线衍射谱。 可以看出, NaAlH4完全分解为Na3AlH6和Al, 并有NaH生成, 但不是主相, 量相对较少, 同时发现了少量的TiAl3, 说明在本实验所设条件下氢化铝钠分解反应(1)完全发生而反应(2)部分进行; 图1(b)所示为该试样吸氢后的X射线衍射谱, 发现除了少量残余的Al和TiAl3, NaH和Na3AlH6基本完全消失, 转化为NaAlH4, 这就证明了反应的可逆性。
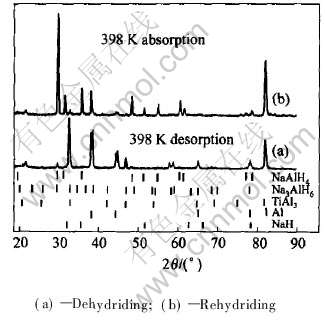
图1 NaAlH4+2%Ti化合物机械球磨放氢后和吸氢后的X射线衍射谱
Fig.1 XRD patterns of 2% Ti-compound+NaAlH4 mixture after ball-milling
图2所示为氢化铝钠原料和通过高能球磨法加入2%钛化合物催化后氢化铝钠的微观形貌。 图2(a)所示为低倍时氢化铝钠原料的形貌。 颗粒较均匀, 大小在几十个微米以上, 经过机械合金化法加入钛化合物催化剂后, 试样变成均匀细小的微米级颗粒。 选取大小适中的颗粒进行进一步的观察, 如图2(b)所示该颗粒在高倍下的微观形貌。 可见表面很粗糙, 布满了更细小的纳米级微球, 较为整齐的排列在微粒表面。 这种微观结构比表面积大, 有利于扩大材料与氢气的接触面积, 从而提高了吸放氢反应的动力学。 能谱分析表明, 催化剂钛分布也比较均匀, 这说明通过高能球磨法将钛基催化剂均匀地分散到了材料中。
2.2 吸放氢性能测试
图3所示为150℃下通过高能球磨加入2%钛化合物催化后的氢化铝钠试样吸放氢动力学曲线。 所有曲线为同一试样不同循环次数下的吸放氢动力学性能, 由于放氢动力学在反应(2)中动力学极差,
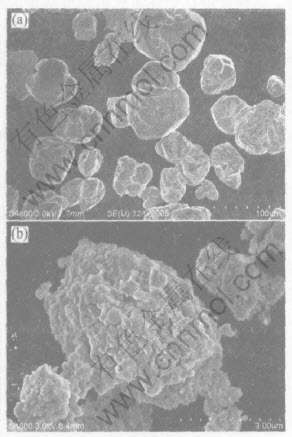
图2 NaAlH4原料和2%钛化合物球磨后的SEM形貌
Fig.2 SEM images of NaAlH4 (a) and 2% Ti-compound after ball-milling (b)
图3 NaAlH4+2%钛化合物机械球磨后150℃下吸放氢动力学曲线
Fig.3 Rehydriding (a) and dehydriding (b) kinetic curves of 2% Ti-compound+NaAlH4 after ball-milling at 150℃
因此开始下一次吸放氢循环以前抽真空以确保上一循环所吸的氢完全放出。 吸氢条件为150℃、 8MPa, 放氢条件为150℃、 0.1MPa。 从图3(a)可以看出, 在刚开始的十几分钟内, 该材料吸氢非常迅速, 吸氢量达到2%以上, 但是接着出现一个近似平台的阶段, 然后又开始缓慢吸氢, 最大吸氢量大于4%。 通过该图所示曲线可以看出, 通过机械合金化掺杂的氢化铝钠吸氢动力学良好。 在图3(b)所示的放氢动力学曲线中, 在2h内基本上放氢完毕, 这说明该材料在150℃、 0.1MPa下的放氢动力学有了很大提高。 第一次放氢的放氢量为4.59%, 与理论值5.6%的放氢量尚有差距, 这是因为氢化铝钠本身含有杂质, 而且催化剂在样品中占去了一部分比例。 从第二次开始, 放氢量基本上达到3%以上, 最大放氢量为3.39%, 放氢动力学随着循环次数的增加略有衰减。 这可能与催化剂活性的降低有关, 需要作进一步的研究。
图3(a)所示的吸氢动力学曲线中, 开始阶段吸氢特别迅速, 主要发生的反应为
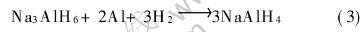
接着出现极缓慢的增长阶段, 此时发生的反应为
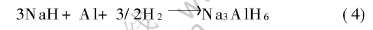
反应(4)的动力学很差, 但经过一段时间后, 由于生成了Na3AlH6, 反应(3)和(4)同时进行, 故吸氢速度又加快。 图3(b)所示的放氢曲线主要是发生反应(1)的结果, 而经过开始的2h后放氢趋于缓慢则是由于反应(2)动力学极差的缘故。 实验证明, 在足够长的时间后, 试样的放氢量几乎与吸氢量相当。 这就是说该催化剂对反应(1)动力学改进明显, 而对反应(2)动力学改进不明显。 这与Zidan等[12]的有关报道一致
图4所示为该试样在150℃下的吸放氢循环性能。 以球磨完的试样直接放氢为第一次放氢。 总体来看, 吸氢量稳定在4%左右, 而放氢量则稳定在3%, 这一差别的主要原因与吸放氢的条件有关。 吸氢条件是高压达8MPa, 使反应(3)向右进行, 对提高吸氢量有利; 放氢条件是对一个大气压放氢, 不利于反应(1)和(2)正向进行。 实验证明, 该试样在真空下放氢速度更快, 放氢量与吸氢量基本吻合。
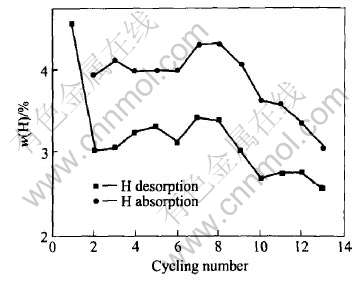
图4 NaAlH4+2%钛化合物机械球磨后150℃下的吸放氢循环性能
Fig.4 Cyclic capacities of 2% Ti-compound+NaAlH4 mixture after ball-milling at 150℃
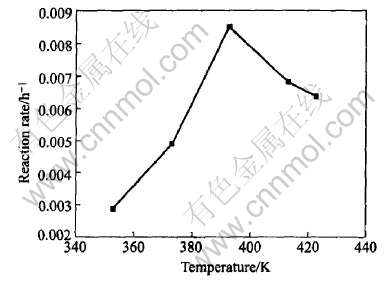
图5 NaAlH4+2%钛化合物机械球磨后不同温度的吸氢速率
Fig.5 Rehydriding rate of NaAlH4+2%Ti-compound at different temperatures
图5所示为NaAlH4+2%钛化合物球磨后的试样在不同温度下吸氢速率的对比。 可以看出, 该试样在较低的温度下吸氢速率较小, 在373K以下的吸氢动力学性能很差。 随着吸氢温度的提高, 吸氢速率迅速提高, 在393K时达到最大, 但在更高温度下试样的吸氢速率又开始下降。 这一规律可以通过氢化铝钠的吸氢反应速率方程得到解释。 氢化铝钠的吸氢反应速率方程可表示为
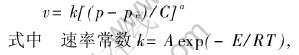
和平衡压pe及温度有关[13]。 随着吸氢温度的升高, 开始阶段k的增加处于主导地位, 因此吸氢速率v增加; 超过393K时pe的增大处于主导地位, 导致v开始减小。 这说明, 吸氢温度不宜过高和过低, 最佳的吸氢温度应在393K。
2.3 催化机理探讨
为了探讨钛催化剂在氢化铝钠分解中的作用机理, 对催化球磨后的试样进行了X射线光电子能谱分析(XPS)。 图6所示为NaAlH4+2%钛化合物球磨后的试样进行XPS分析钛元素价态结果。 Ti4+的2p3/2峰应出现在458.8eV, 而在图中位于453.9eV的峰为零价态的钛2p3/2, 另一个2p3/2的峰位于456.8eV, 因此钛元素的另一种价态为(4-x)。 因此, 高能球磨法在氢化铝钠中加入钛化合物的过程中, 氧化态的四价钛离子与强还原剂氢化铝钠发生了氧化还原反应, 生成的零价钛离子和(4-x)价钛离子在吸放氢循环过程中起催化作用。 但具体的反应机理还不明确。
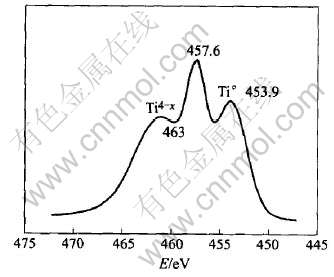
图6 NaAlH4+2%Ti(OBu)4试样钛元素的X射线光电子谱
Fig.6 XPS pattern of Ti in NaAlH4+2%Ti-compound
3 结论
1) NaAlH4通过机械合金化法加入2%钛化合物为催化剂, 大大改进了其热力学性能及吸放氢动力学性能。
2) 机械合金化法掺杂催化改性后的NaAlH4, 可逆吸氢量可达4%, 放氢量大于3%。
3) 钛催化剂对反应(1)动力学改进显著, 而对反应(2)动力学改进帮助不大。
REFERENCES
[1]Koppel T. Powering the Future[M]. Canada: Wiley, Etobicoke, 1999.
[2]Schlapbach L. Topics in Applied Physics(Vol 76)[M]. Springer-Verlag, 1992. 197.
[3]Sandrock G, Thomas G. Hydride Databases[EB/OL]. http: //hydpark.ca.sandia.gov.
[4]Yurum Y. Hydrogen Energy Systems: Production and Utilization of Hydrogen and Future Aspects[M]. Kluwer Academic Press, 1994. 253.
[5]Jensen C M, Gross K J. Development of catalytically enhanced sodium aluminum hydride as hydrogen storage material[J]. Appl Phys A, 2001, 72: 213.
[6]Meisner G P, Tibbetts G G, Pinkerton F E, et al. Enhancing low pressure hydrogen storage in sodium alanates[J]. Journal of Alloys and Compounds, 2002, 337: 254-263.
[7]Bogdanovic B, Schwickardi M. Ti-doped alkali metal aluminium hydrides as potential novel reversible hydrogen storage material[J]. Journal of Alloys and Compounds, 1997, 253: 1-9.
[8]Sandrock G, Gross K, Thomas G. Effect of Ti-catalyst content on the reversible hydrogen storage properties of the sodium alanates[J]. Journal of Alloys and Compounds, 2002, 339: 299-308.
[9]Bogdanovic B, Brand R A, Marjanovic A, et al. Metal-doped sodium aluminium hydrides as potential new hydrogen storage materials[J]. Journal of Alloys and Compounds, 2000, 302: 36-58.
[10]Zaluska A, Zaluski L, Strom-Olsen J O. Sodium alanates for reversible hydrogen storage[J]. Journal of Alloys and Compounds, 2000, 298, 125-134.
[11]LUO Wei-fang, Kal J Gross. A Kinetics model of hydrogen absorption and desorption in Ti-doped NaAlH4[J]. Journal of Alloys and Compounds, 2004, 385: 224-231.
[12]Zidan R A, Takara S, Hee A G, et al. Hydrogen cycling behavior of zirconium and titanium-zirconium-doped sodium aluminum hydride[J]. Journal of Alloys and Compounds, 1999, 285: 119-122.
[13]SUN Da-lin, Srinivasan S S, CHEN Guo-rong, et al. Rehydrogenation and cycling studies of dehydrogenated NaAlH4[J]. Journal of Alloys and Compounds, 2004, 373: 265-269.
(编辑陈爱华)
收稿日期: 2005-11-15; 修订日期: 2006-03-21
通讯作者: 王树茂, 教授; 电话: 010-82241238; E-mail: hydrogen@mail.grinm.com.cn