文章编号: 1004-0609(2006)05-0781-05
AZ31镁合金在MgSO4溶液中的电化学行为
陈昌国, 司玉军, 余丹梅, 刘渝萍, 杨祖洪, 王 琪, 李 兰
(重庆大学 化学化工学院, 重庆 400044)
摘 要: 用线性电位扫描、 Tafel极化曲线、 恒流放电、 交流阻抗、 失重法等方法研究AZ31镁合金在MgSO4溶液中的电化学行为, 考察其作为电池负极材料的性能, 并研究十二烷基苯磺酸钠对AZ31镁合金的缓蚀性能。 结果表明: 负差效应的存在极大降低AZ31镁合金的电流效率; 未经放电时, 合金自放电电流密度小, 但放电后, 自放电增强, 存储能力降低。 十二烷基苯磺酸钠能对AZ31合金起到缓蚀作用, 提高放电电流效率, 但会使续放电时出现电位滞后的现象。
关键词: 镁电池; 负极材料; 负差效应; 缓蚀剂; 十二烷基苯磺酸钠 中图分类号: TM911
文献标识码: A
Electrochemical behavior of
AZ31 magnesium alloy in MgSO4 solution
CHEN Chang-guo, SI Yu-jun, YU Dan-mei, LIU Yu-ping, YANG Zu-hong, WANG Qi, LI Lan
(College of Chemistry and Chemical Engineering, Chongqing University,
Chongqing 400044, China)
Abstract: The electrochemical behavior of AZ31 magnesium alloy in MgSO4 solution was investigated by linear potential scan, Tafel polarization curve, constant-current discharge, electrochemical impedance spectroscopy and mass-loss measurements, in order to examine its performance as negative material of battery. The inhibiting ability of sodium dodecyl benzene sulfonate was also studied. The results indicate that the current efficiency of AZ31 alloy is low because of negative difference effect (NDE) and shelf-life decreases after discharge. Sodium dodecyl benzene sulfonate can inhibit the corrosion of alloy and increases the current efficiency of discharge, but it induces a potential lag at the beginning of sequel dischage.
Key words: magnesium battery; anodic material; negative difference effect; corrosion inhibitor; sodium dodecyl benzene sulfonate
镁是活泼金属, 标准电极电位负、 密度小、 理论比容量高(2.22A·h/g, 在常见的金属中仅比锂、 铝小); 镁资源比较丰富, 成本低; 镁对环境友好, 安全性高。 因此, 镁是一种很有前途的电池负极材料[1-3]。 但是, 在中性和酸性条件下, 镁与水剧烈反应, 并放出氢气; 碱性条件下, 在其表面形成致密的保护膜而使电极钝化; 另外, 镁在放电时存在比较严重的负差效应, 降低了电流效率[4-6]。 因此, 目前镁主要还是用作铝的合金化添加剂, 只有部分用于电化学领域[7]。
镁及其合金在电池中的研究与应用主要集中在原电池[8, 9]、 海水激活电池[10, 11]、 镁/空气燃料电池[2]、 非水体系的二次镁离子电池[12, 13]以及镁基储氢合金电池等[14, 15]领域。 储氢合金电池中, 镁本身并不参与电化学反应, 而是利用镁在一定的条件下能可逆地吸收和放出氢气的性能而作为储氢的载体, 研究重点是解决较高的脱氢温度和相对较慢的吸放氢动力学过程。 二次镁离子电池的研究尚处于起步阶段, 负极通常都是用纯镁, 但研究的重点并不是负极材料, 而是寻找合适的电解质体系, 使镁能够稳定存在于其中, 并能够进行可逆的电化学溶解和沉积, 以及研究与之相适应的可供镁离子可逆嵌脱的正极材料。 Aurbach等 [12]较早进行这方面的研究, 他们以镁为负极、 Mo3S4为正极、 Mg(AlCl2BuEt)2的THF溶液为电解液, 成功组装了具有实际意义的二次镁离子电池。
原电池、 海水激活电池以及镁/空气燃料电池对镁负极则有严格的要求。 在这样的体系中, 研究重点之一是合成合适的镁合金, 使其具有良好的储存能力、 较高的放电效率。 常规镁合金中AZ31具有较高的放电效率, 但却存在放电滞后的问题; AZ10具有与之相反的特征; AZ21则结合了二者的优点; 目前性能较好的是含铅的AP65合金。 最近, 马正青等 [16]合成了含镓的镁合金, 并在人造海水中表现出良好的电化学性能, 利用率可达82.4%。 Sivashanmugam等 [9]合成了含锂的镁合金, 锂含量达13%, 表现出了较负的开路电位, 以8.6mA/cm2的电流密度放电时阳极电流效率为81%。 然而, 由于镁自身的活泼性和镁合金的制备难度, 在这方面的研究报道还不多见。 另外, 对于此类电池的研究, 寻找合适的电解质溶液和添加缓蚀剂也是一个出发点。
为此, 本文作者研究了AZ31镁合金在MgSO4溶液中作为电池负极材料的电化学行为, 同时考察十二烷基苯磺酸钠作为一种缓蚀剂对其电化学性能的影响。
1 实验
1.1 材料和仪器
AZ31镁合金的组成为(质量分数): 3%Al、 1%Zn、 0.2%Mn, 余量为Mg。 电解液由分析纯MgSO4溶解于蒸馏水而得; 作为缓蚀剂的十二烷基苯磺酸钠为分析纯, 先将其溶解, 再根据需要量进行添加。
测试仪器为CHI660A电化学工作站(美国产)。 采用三电极体系, 石墨作辅助电极, 饱和甘汞电极为参比电极。 研究电极的制备方法为: 将合金打磨成均匀条形, 置于一塑料筒中, 再用环氧树脂填充包裹, 留出测试面(面积4mm2); 恒流放电和自放电测试用的电极制成总面积约为2cm2的片状。
1.2 自放电速率测量
准确测出待测样的初始质量(m0)和面积(S), 用一细塑料线将其系住, 悬放入50mL电解液中, 使其不与容器底部接触, 约50h后取出清洗, 再放入65℃的250g/L的铬酸溶液中浸泡15min, 取出后蒸馏水清洗、 热风吹干称质量(m1)。 自放电速率(用电流密度表示)计算式如下:
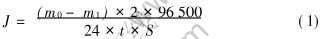
式中 J为自放电速率, mA/cm2; m为质量, mg; t为时间, s; S为面积, cm2。
1.3 动电位扫描和Tafel极化曲线测试
测试前工作电极经700、 1000、 2500号砂纸逐级打磨, 蒸馏水冲洗后, 快速放入电解液中进行测试。 动电位扫描速度为10mV/s; Tafel极化曲线扫描速度为2mV/s。
1.4 恒流放电测量
准确测出测试电极的初始质量(m′0)和面积(S′), 在不同的电流密度(J′)下进行放电, 放电结束后用蒸馏水清洗, 放入65℃的250g/L的铬酸溶液中浸泡15min, 取出后蒸馏水清洗、 热风吹干称质量(m′1)。 电流效率(η)按式(2)计算:
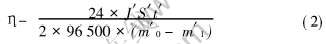
即为在规定放电时间和电流密度下, 按纯镁计算理论质量损失与实际质量损失的比值。
1.5 交流阻抗测试
测试的频率范围为0.1~105Hz, 初始电位为Tafel极化曲线所确定的开路电位, 交流电位幅值为5mV, 测试前电极在电解液中静置90s。
2 结果与讨论
2.1 AZ31镁合金在MgSO4溶液中的电化学行为
2.1.1 AZ31镁合金在MgSO4溶液中的线性电位扫描
首先用线性电位扫法描研究了AZ31合金在不同浓度MgSO4溶液中的行为, 结果如图1所示。 可以看出, 合金具有较负的开路电位和活化电位, 但性能受MgSO4溶液浓度影响。 浓度小和接近饱和时活化性能都较差, MgSO4的最佳浓度值在1.2~2.0mol/L之间。
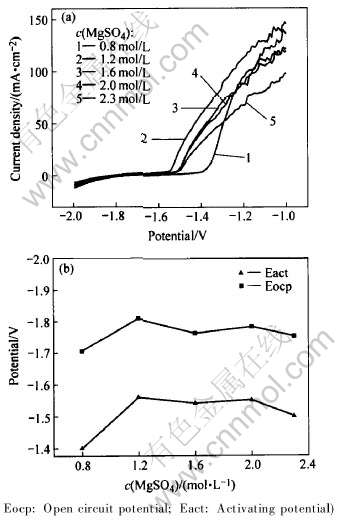
图1 MgSO4浓度对AZ31合金活化性能的影响
Fig.1 Relationship between electrochemical performance of AZ31 alloy and concentration of MgSO4
2.1.2 AZ31镁合金在MgSO4溶液中的恒流放电
AZ31镁合金在不同浓度MgSO4溶液中的恒流放电如图2所示。 可以看出电解质溶液浓度大时, 初始阶段可以得到更加平稳和更负的放电电位; 随着放电的继续进行, 低浓度体系的放电性能更好。 这是因为随着溶液浓度增大, 溶液的电导率也增大; 实验中还观察到在浓度较大的溶液中, 放电产物容易从电极表面脱落, 不致引起大的极化。 但是溶液接近饱和时(图2(b)), 放电开始后电极附近Mg2+对MgSO4迅速过饱和, 使溶液中很快就有无色晶体析出并附着在工作电极上, 产生严重的阳极极化, 即使是在较小的电流密度下放电也出现同样的现象, 只是时间稍长。
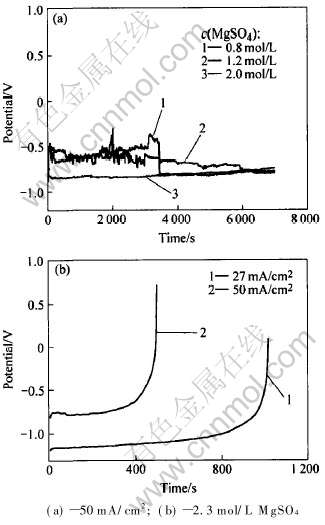
图2 AZ31合金在不同浓度MgSO4溶液中的恒流放电
Fig.2 Discharge of AZ31 alloy in different
concentration solution of MgSO4
恒流放电实验中, 通电后电极表面气泡的产生(析氢)马上就剧烈起来, 表明电极表面的钝化膜受到破坏, 析氢自腐蚀增强。 同时, 电极表面不断有不溶物脱落, 将此脱落物用蒸馏水冲洗后放入稀硫酸中, 部分迅速溶解, 是放电产物Mg(OH)2; 另有部分溶解较慢, 在其表面伴有气泡的放出, 说明有金属存在。
2.1.3 自放电速率和电流效率
为考察AZ31镁合金的自放电情况, 用失重法测量在1.2mol/L MgSO4溶液中3个条件下的自放电和电流效率: 1) 直接将被测试样浸泡于溶液中, 时间为55h; 2) 测试电极连续恒流放电7000s; 3)间歇放电。 先将测试电极恒流放电2000s后, 静置于溶液中52h, 再恒流放电5000s。 以上放电均在50mA/cm2的电流密度下进行。
实验测得连续放电的电流效率为74%, 间歇放电的电流效率为71%; 两者的差值由放电间歇的自放电造成, 其速率为0.1mA/cm2; 而未经放电的样品自放电速率为0.08mA/cm2。
由此可知, 镁电极经放电后, 表面膜受到不可复原的破坏, 使得在放电间歇也以较大的速度自放电, 即间歇放电时的湿态存储能力降低。 同时, 镁合金负极的利用率较低, 即存在较大的负差效应, 直观的原因是通电后电极的表面膜被破坏导致其析氢自腐蚀速度加快, 以及放电过程中有未参与电化学反应的金属直接脱落。
采用15mA/cm2的较小电流密度放电时, 放电效率可提高到78%, 电流密度对电流效率也有较大的影响。
2.2 十二烷基苯磺酸钠对AZ31的缓蚀作用
2.2.1 Tafel极化曲线和交流阻抗谱(EIS)
AZ31镁合金在含不同浓度十二烷基苯磺酸钠的1.2mol/L MgSO4溶液中的Tafel极化曲线如图3所示。 十二烷基苯磺酸钠的加入使电极的开路电位和活化电位都有正移, 添加剂浓度越大, 正移的幅度也越大。
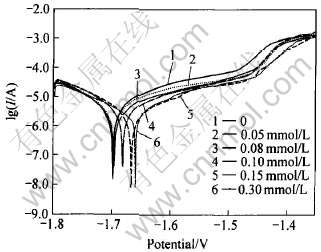
图3 不同浓度十二烷基苯磺酸钠对AZ31合金Tafel曲线的影响
Fig.3 Tafel curves of AZ31 alloy in different
concentrations of sodium dodecyl benzene sulfonate
图4所示为AZ31镁合金在含不同浓度十二烷基苯磺酸钠的MgSO4溶液中的交流阻抗图谱。 不同浓度下的图谱具有相似性, 即由高频、 中频处的两个容抗环组成。 高频处的环是由电荷传递引起, 其直径可以近似看作电极反应电荷传递电阻; 中频处的环是由吸附在电极表面的物质的弛豫过程引起[17, 18]。 随缓蚀剂浓度增大, 电荷传递电阻也增大, 说明缓蚀性增强。 结合Tafel极化曲线可知, 十二烷基苯磺酸钠的加入使镁的阳极溶解反应受到抑制, 腐蚀电位正移, 属于阳极型缓蚀剂。
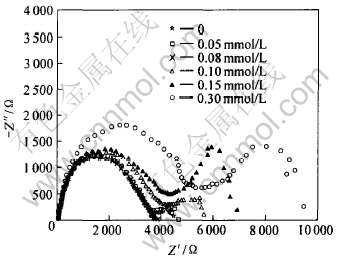
图4 不同浓度十二烷基苯磺酸钠对AZ31合金交流阻抗谱的影响
Fig.4 Electrochemical impedance spectroscope of AZ31 at different concentrations of sodium dodecyl benzene sulfonate
2.2.2 恒流放电
图5所示为AZ31镁合金在含0.05mmol/L十二烷基苯磺酸钠的1.2mol/L MgSO4溶液中的间歇放电曲线(电流密度为50mA/cm2)。 图中曲线1为首次放电。 可以看出, 随着放电的进行, 电极电位逐渐正移; 曲线2为电极首次放电后, 再静置54h后的续放电曲线, 由于电极表面在静置期间生成了保护膜, 使得再次放电时的电极阳极极化增强, 电极电位升高; 但是随着放电的进行, 电极表面的膜逐渐脱落, 电极电位逐渐负移。 此间歇放电测得的电流效率为72.5%; 放电间歇的自放电速率为0.07mA/cm2。 AZ31镁合金在同一溶液中以50mA/cm2的电流密度放电7000s, 电流效率为74.8%。 可见, 十二烷基苯磺酸钠的加入使得AZ31镁合金的连续放电和间歇放电的效率都有提高, 静置时的自放电速率减小, 说明其确实起到缓蚀作用。
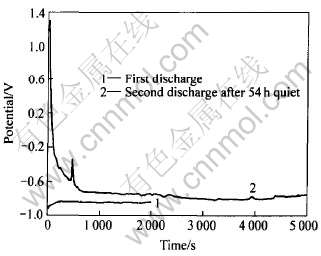
图5 AZ31合金在含十二烷基苯磺酸钠的
MgSO4溶液中的间歇恒流放电曲线
Fig.5 Intermittent discharge of AZ31 alloy in MgSO4 solution containing sodium dodecyl benzene sulfonate
3 结论
1) AZ31镁合金在MgSO4溶液中具有较低的开路电位和活化电位, 但放电时负差效应明显, 降低了电流效率。 经放电后, AZ31镁合金的自腐蚀放电加速, 湿态存储能力降低。
2) 十二烷基苯磺酸钠能够对AZ31镁合金起到一定的缓蚀作用, 提高放电电流效率和湿态储存能力, 但是提高的幅度对负差效应的抑制作用有限; 同时, 缓蚀剂的加入使续放电初期出现电位滞后的问题。
REFERENCES
[1]Udhayan R, Devendra P B. On the corrosion behaviour of magnesium and its alloys using electrochemical techniques[J]. J Power Sources, 1996, 63: 103-107.
[2]唐有根, 黄伯云, 卢凌彬, 等. 金属燃料电池[J]. 物理, 2004, 33(2): 85-89.
TANG You-gen, HUANG Bai-yun, LU Ling-bin, et al. Metal fuel cells [J]. Physics, 2004, 33(2): 85-89.
[3]Balasubramanian R, Veluchamy A, Venkatakrishnan N, et al. Electrochemical characterization of magnesium/silver chloride battery[J]. J Power Sources, 1995, 56: 197-199.
[4]Song G, Atrens A, Wu X, et al. Corrosion behaviour of AZ21, AZ501 and AZ91 in sodium chloride[J]. Corrosion Science, 1998, 40(10): 1769-1791.
[5]李瑛, 宋光铃, 林海潮, 等. 金属镁在腐蚀介质中界面结构特征与负差数效应关系研究[J]. 腐蚀科学与防护技术, 1999, 11(4): 202-208.
LI Ying, SONG Guang-ling, LIN Hai-chao, et al. Study on the relationship between the corrosion interface structure and negative difference effect for pure magnesium[J]. Corrosion Science and Protection Technology, 1999, 11(4): 202-208.
[6]Song G, Atrens A, Stjohn D, et al. The electrochemical corrosion of pure magnesium in 1N NaCl[J]. Corrosion Science, 1997, 39(5): 855-875.
[7]张永君, 严川伟, 王福会, 等. 镁的应用及其腐蚀与防护[J]. 材料保护, 2002, 35(4): 4-6.
ZHANG Yong-jun, YAN Chuan-wei, WANG Fu-hui, et al. Application, corrosion and protection of magnesium and its alloys[J]. Materials Protection, 2002, 35(4): 4-6.
[8]Oxley J E, Ekern R J, Dittberner K L, et al. Magnesium dry cells[A]. Power Sources Symposium, 1992, IEEE 35th International[C].1992.18-21.
[9]Sivashanmugam A, Kumar T P, Renganathan N G. Performance of a magnesium-lithium alloy as an anode for magnesium batteries[J]. J Applied Electrochemistry, 2004, 34: 1135-1139.
[10]Hasvold , Lian T, Haakaas E, et al. CLIPPER: a long-range, autonomous underwater vehicle using magnesium fuel and oxygen from the sea[J]. J Power Source, 2004, 136: 232-239.
[11]Lee K B, Sammoura F, Lin L. Water activated disposable and long shelf life microbatteries[A]. Proceeding of the Sixteenth Annual International Conference[C]. IEEE, 2003. 387-390.
[12]Aurbach D, Lu Z, Schechter A, et al. Prototype systems for rechargeable magnesium batteries[J]. Nature, 2000, 407: 724-728.
[13]Aurbach D, Weissman I, Gofer Y. Nonaqueous magnesium electrochemistry and its application in secondary batteries[J]. The Chemical Record, 2003, 3: 61-73.
[14]王毅, 邱晓航, 申泮文. 镁基储氢材料研究新进展[J]. 化学通报, 2004, 5: 327-332.
WANG Yi, QIU Xiao-hang, SHEN Pan-wen. Recent progress of Mg-based hydrogen storage materials[J]. Chemistry Bulletin, 2004, 5: 327-332.
[15]房文斌, 张文丛, 于振兴, 等. 镁基储氢材料的研究进展[J]. 中国有色金属学报, 2002, 12(5): 853-862.
FANG Wen-bin, ZHANG Wen-cong, YU Zheng-xin, et al. Recent development of Mg-based hydrogen storage material[J]. The Chinese Journal of Nonferrous Metal, 2002, 12(5): 853-862.
[16]马正青, 黎文献, 余琨, 等. 海水介质中高活性镁合金负极的电化学性能[J]. 材料保护, 2002, 35(12): 16-18.
MA Zheng-qing, LI Wen-xian, YU Kun, et al. Eletrochemical characteristics of magnesium alloys in synthetic seawater[J]. Materials Protection, 2002, 35(12): 16-18.
[17]Baril G, Pebere N. The corrosion of pure magnesium in aerated and deaerated sodium sulphate solutions[J]. Corrosion Science, 2001, 43: 471-484.
[18]Song G, StJohn D. Corrosion behaviour of magnesium in ethylene glycol[J]. Corrosion Science, 2004, 46: 1381-1399.
收稿日期: 2005-09-27; 修订日期: 2005-12-05
通讯作者: 陈昌国, 教授; 电话: 023-65111748; E-mail: cgchen@cqu.edu.cn
(编辑陈爱华)