网络首发时间: 2015-04-07 09:27
稀有金属 2016,40(05),473-477 DOI:10.13373/j.cnki.cjrm.2016.05.011
以Li_2CO_3为原料制备金属锂过程的电化学还原机制
张保国 李继东 赫婷婷 王一雍
辽宁科技大学材料与冶金学院
摘 要:
953 K下,在Li Cl-Li F-Li_2CO_3纯锂盐体系中,采用电化学手段(循环伏安法,计时电流法)研究了熔盐电解碳酸锂制备金属锂的电极过程,重点分析了锂的还原机制和碳酸根离子的放电行为。研究表明,金属锂在钨电极上的还原是锂离子一步得电子的可逆反应过程,在氯气析出峰前的氧化峰为碳酸锂在电场作用下分解为二氧化碳和氧化锂,氧化锂中的氧离子放电生成氧气所致,电场的作用促进了碳酸锂的分解。计时电流表明锂离子的沉积速率受扩散控制,经计算锂离子在熔盐中扩散系数为1.35×10~(-8)cm~2·s~(-1),成核过程是半球形三维瞬时成核。碳酸锂的加入比传统的以Li Cl为原料熔盐电解法制备金属锂或者合金实际分解电压低0.5 V,从而降低了电解过程电压,较少了能源消耗;使用碳酸锂作原料熔盐电解法制备金属锂不仅减少了环境污染还降低了锂的生产成本。
关键词:
Li2CO3;金属锂;还原机制;电沉积;熔盐电解;
中图分类号: TF826.3
作者简介:张保国(1990-),男,山东曹县人,硕士,研究方向:熔盐电化学;E-mail:zbg_23@163.com;;李继东,副教授;电话:0412-5929559;E-mail:lijidong1014@163.com;
收稿日期:2014-11-27
基金:国家自然科学基金项目(51204094);辽宁省教育厅一般项目(L2012092);鞍山市科技项目(2012MS02)资助;
Electrochemical Reduction Mechanism of Preparation of Lithium Metal Using Li_2CO_3 as Raw Material
Zhang Baoguo Li Jidong He Tingting Wang Yiyong
School of Materials and Metallurgy,University of Science and Technology Liaoning
Abstract:
Electrochemical reduction mechanism of preparation of lithium metal in Li Cl-Li F-Li_2CO_3 pure lithium salt system was analyzed at 953 K using electrochemical methods( cyclic voltammetry,chronoamperometry). Cyclic voltammetry results showed that the lithium reduction of tungsten electrode was reversible reaction by one step gaining electronic; there was a oxidation peak before chlorine precipitation peak and it resulted from the decomposition of Li_2CO_3 to CO_2and Li_2 O and the oxygen ion from Li_2 O discharged to generate oxygen; further,the electric field enhanced the decomposition of Li2CO3; chronoamperometry showed that the deposition rate of lithium ion was controlled by diffusion and the diffusion coefficient was 1. 35 × 10~(- 8)cm~2·s~(- 1); the nucleation process was hemispherical three-dimensional instantaneous nucleation. The addition of lithium carbonate to Li Cl-Li F system to prepare metal lithium or the alloy consumed less energy than traditional method because it could reduce 0. 5 V in electrolytic process; using Li2CO3 as raw material in lithium electrolysis production was regarded as the new trend because it would not only minimize the environmental pollution but also reduce the cost.
Keyword:
Li2CO3; lithium metal; reduction mechanism; electrodeposition; molten salt electrolysis;
Received: 2014-11-27
随着锂在冶金、石油、化工等传统领域的广泛应用,特别在航空航天、能源电池、热核聚变、轻质合金等新兴技术领域的不断拓展,使得近年来金属锂的生产规模和产量得到迅猛发展,被称为21世纪的能源金属[1,2]。
传统生产金属锂方法是以氯化锂为原料电解氯化锂-氯化钾熔盐,阳极放出氯气,对环境污染很大且原料昂贵[3,4]。如能以更廉价的碳酸锂代替氯化锂为电解原料,不但降低了槽电压,减轻了对设备的腐蚀,而且阳极产物由原来的氯气改为二氧化碳,减少了净化氯气所耗费的费用,更进一步降低了成本。目前,采用氟化物体系熔盐电解提取金属的研究比较广泛[5,6],但以碳酸锂为原料进行锂电解的相关研究报道比较少,考虑到阴极产物金属锂的活性较大,通常以阴极合金化的形式进行阴极产物收集制备铝锂合金。东北大学Gao等[7]研究了以碳酸锂为原料在Li F-Ca F2体系中以铝铜合金为阴极成功制备了铝铜锂合金,同时经过比较研究证明了Li F-Ca F2体系中在加入碳酸锂会由于生成碳酸钙导致电解质发粘的问题。采用纯锂盐氟氯混合体系为主的新型电解质体系,和更为廉价的Li2CO3为原料代替氯化物对熔盐电解过程进行研究,采用连续脉冲-计算机法测量阳极过电压并研究极化曲线的变化[8,9,10],在此基础上,本文采用循环伏安和计时电流的测试技术研究了金属锂的还原机制以及碳酸根放电的电化学行为,这为以碳酸锂为原料采用熔盐电解法连续制备金属锂或者合金提供了理论依据。
1 实验
1.1 电化学实验装置
采用三电极系统进行电化学研究,工作电极为钨丝(直径1.0 mm,实验前将其表面用砂纸打磨抛亮使其有良好导电性),对电极采用光谱纯石墨棒(直径6.0 mm),参比电极为Ag/Ag Cl(1%Ag Cl,质量分数);实验中将三电极插入熔盐1 cm深,并且保证工作电极尽量靠近参比电极。循环伏安,计时电流的测量采用瑞士万通AUTOLAB PG-STAT302N电化学工作站,应用软件为GPES;整个实验过程在温控电阻炉中完成并全程通干燥高纯氩气保护,实验温度为953 K。实验装置如图1所示。
1.2 试剂及过程
采用试剂为国药集团化学试剂,分析纯,其中Li Cl-Li F-Li2CO3的质量比为59∶39∶2,实验前将按比例称量200 g试剂混合均匀,在真空干燥箱内393 K条件下烘干24 h。实验时,将混合均匀的干燥试剂放入刚玉坩埚,置于温控电阻炉内,升温到实验温度953 K,完全熔融后在-2.0 V恒电压下预电解30 min除杂,为保证电化学实验准确性,实验过程需要在较短的时间内完成。
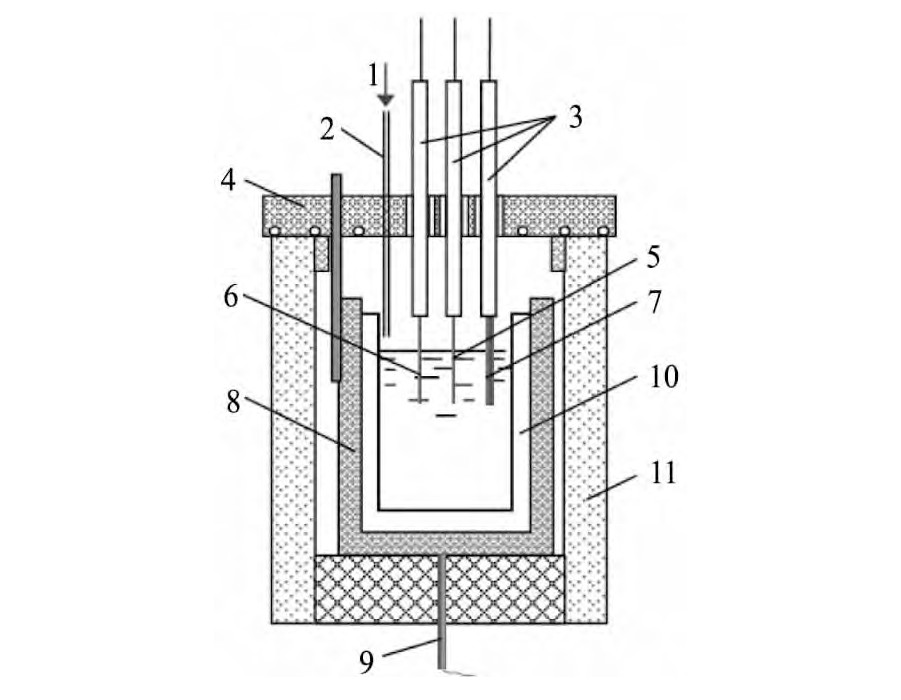
图1 电化学实验装置图Fig.1 Experimental device for electrochemical experiment
1-Drying high pure argon gas;2-Catheter;3-Corundum refractory cover;4-Refractory cover;5-Working electrode(wire W);6-Reference electrode(Ag/Ag Cl);7-Auxiliary electrode(spectrum pure);8-Stainless steel crucible;9-Thermocouple;10-Corundum crucible;11-Resistance furnace
2 结果与讨论
2.1 钨丝工作电极上的循环伏安研究
循环伏安结果如图2所示,扫描起点从E=0开始,顺时针一周扫回原点,扫速为0.1 V·s-1。对于AB段,随着电压的负向增大,电流却没有明显改变,它不遵循法拉第定律,电流为非法拉第电流,只是对双电层的充电过程,属于金属粒子晶核孕育阶段,随着扫描电压至-2.5 V(vs Ag/Ag Cl),出现起峰现象,经短时间电极表面双电层充电结束,并开始有还原反应,金属原子析出,同时锂晶核形成,随着电位的负移,产生晶核逐渐长大的过程,此时金属锂的析出遵循法拉第定律。对于正向扫描电位且扫描电位为正时,电极上伴随有析出气体的氧化反应,此时电极表面很不稳定,所以此时出现了明显不稳定的数据抖动,意味着实际电解中对阳极过程基础研究的复杂性。
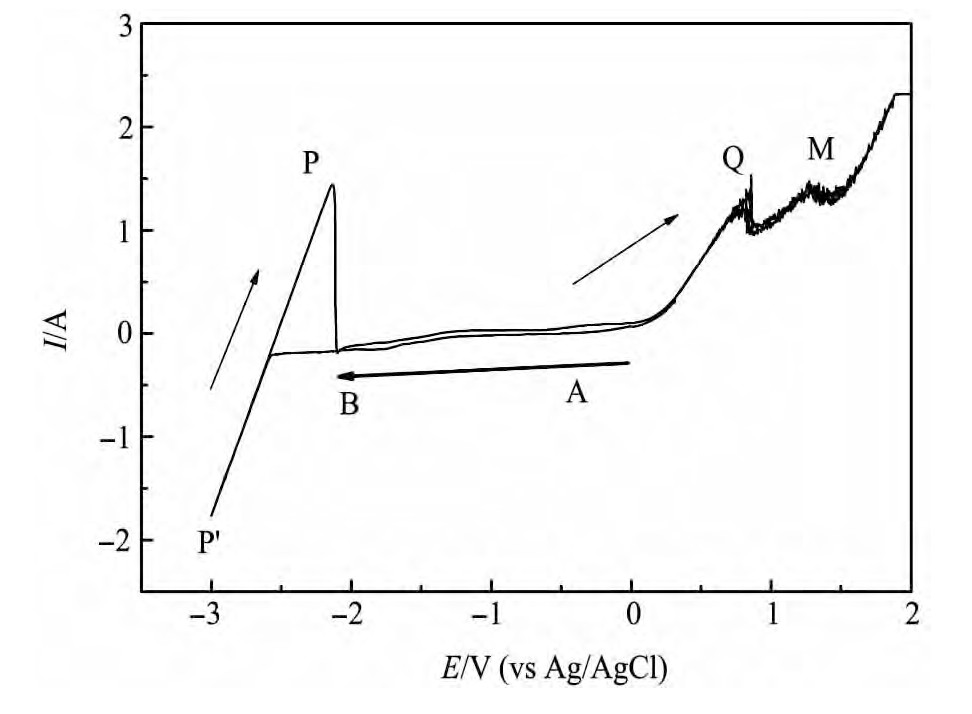
图2 钨电极上的循环伏安图Fig.2Cyclic voltammograms of tungsten electrode with scan-ning speed of 0.1 V·s-1
Li Cl-Li F-Li2CO3纯锂盐体系中,保证了金属还原过程仅有锂离子得电子还原,对应图2中还原峰P',相应的氧化峰为P,根据循环伏安技术基本理论,金属锂氧化峰与还原峰电流之比|Ip/IP'|≈1,判断金属锂的氧化还原过程为一步得失电子可逆过程,反应为

在扫描电压正值区域有明显的两个氧化峰,经热力学计算[11],M为氯气的析出峰,反应为M:

在这之前还有一个氧化峰Q,计算表明它是氧离子失电子变为氧气的氧化峰,反应为Q:

对于Li Cl-Li F-Li2CO3体系,O2-的来源只可能为CO32-,反应为:

在电场的作用下促使反应正向移动。实际电解过程,若采用惰性阳极,只要有Li2CO3存在,阳极气体应为O2,加上碳酸锂分解出的是CO2,这说明以Li2CO3为原料熔盐电解生产金属锂或者其合金,对环境十分友好,然而Li Cl-Li F体系熔解碳酸锂原料能力有限,所以采用周期性加料的方法,用连续脉冲-计算机法监控反电动势的变化进行周期性加料,保证电解原料为Li2CO3,此方法见文献[12-13]。
2.2 计时电流研究
计时电流研究结果如图3所示,对于恒电压E=-2.2,-2.3,-2.4 V(vs Ag/Ag Cl),当负向恒电压逐渐变大,电流趋近于零,这是因为电极表面活性物的浓度由于电解而逐渐减小的结果,对应于图2中的AB段,它应是双电层的充电过程,金属粒子晶核的孕育期。E=-2.5 V,电流出现阶跃现象,对应于循环伏安中的起峰现象电位,随着时间的增加,晶核逐渐长大,析出金属锂;E=-2.6 V,电流阶跃明显,因为阶跃电位越负,过电位越大,晶核越易生成,晶体的生长点也就越多。
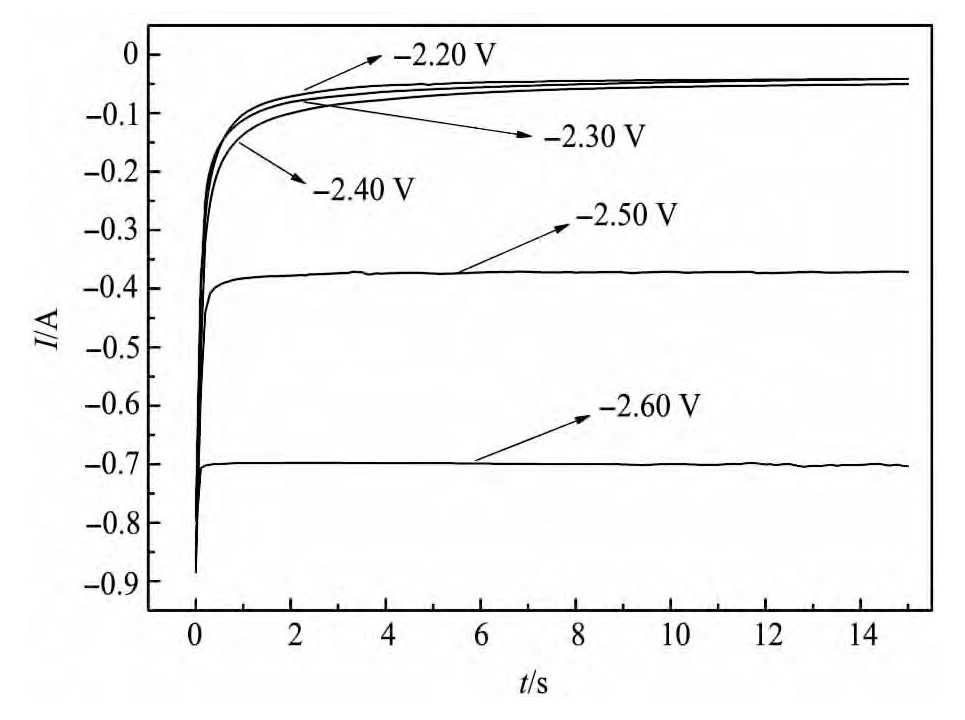
图3 钨电极上不同恒电压下的计时电流曲线Fig.3 Chronoamperometric curves of tungsten electrode under different constant voltages
当恒电压E=-2.4,-2.5 V(vs Ag/Ag Cl)时,作电流对时间平方根倒数关系图如图4,均呈现了出良好的线性关系,这说明阴极金属锂的还原是受扩散控制的,采用Cottrell公式[14]:

式中I为电流强度(A);C0为还原离子熔体浓度(mol·cm-3);F为96500(C·mol-1);N为转移电子数;S为工作电极表面积(cm2);t为电解时间(s);D为扩散系数(cm2·s-1)。
当E=-2.40 V时,拟合直线方程为
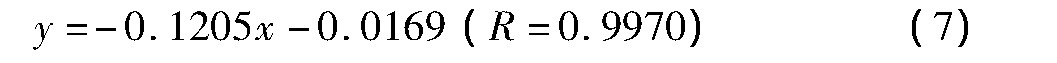

图4 不同电压下,电流对时间平方根倒数关系图Fig.4 Relationship between I and t-1/2at different voltages
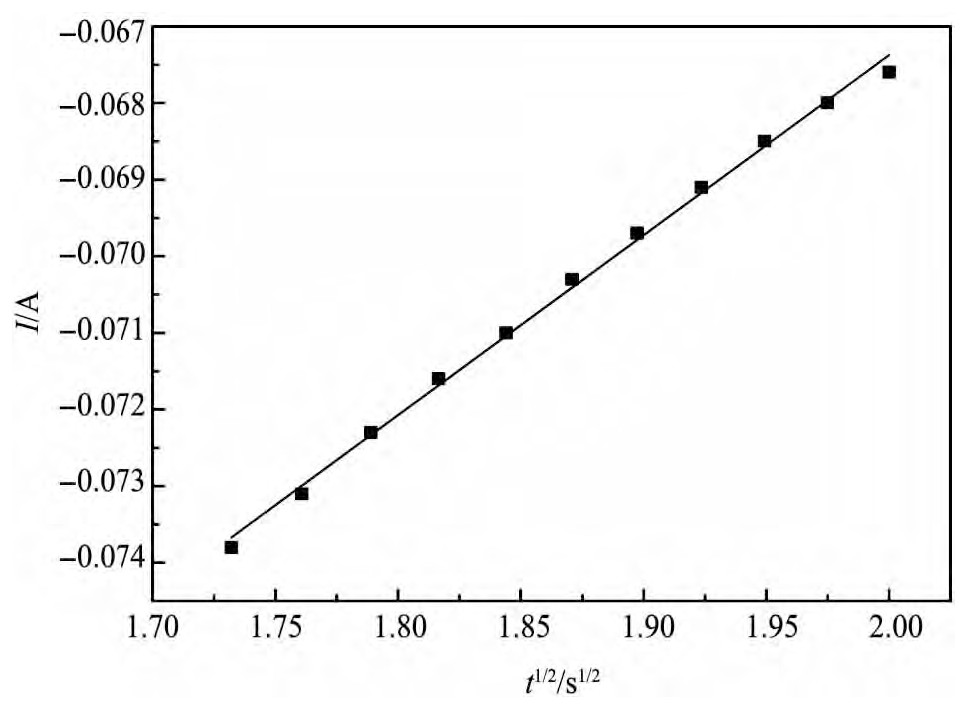
图5 晶核长大时期电流与时间平方根关系Fig.5 Relationship between I and t1/2during period of growth of crystal nucleus
当E=-2.50 V时,拟合直线方程为
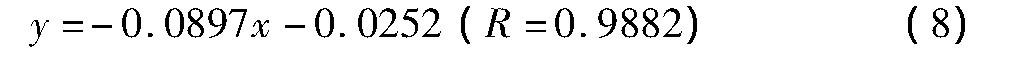
则分别计算出离子扩散系数DE=-2.40 V=1.35×10-8cm2·s-1,DE=-2.50 V=0.75×10-8cm2·s-1,也说明了当电流出现阶跃时,扩散系数会有所降低,因为当有金属析出时,会伴随着周围的锂离子向已经沉积的金属锂上面的扩散过程,这比单纯的在熔盐中扩散要弱[15]。
选取E=-2.5 V中晶核逐渐长大部分数据,作I与t-1关系曲线如图5所示,根据Hills和Schiffrin提出的半球形晶核瞬间成核理论,晶核的形成和长大所产生的电流与时间平方根有如下关系[16]:
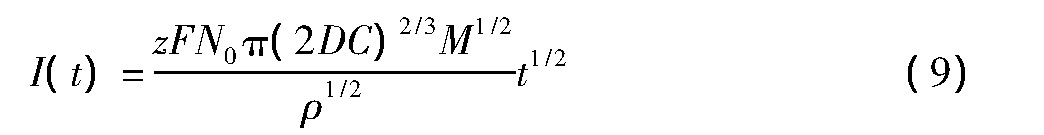
其中z为价数;F为法拉第常数(96500 C·mol-1);N0为晶核数;D为扩散系数(cm2·s-1);C为反应物质浓度(mol·cm-3);M为沉积物质分子量(g·mol-1);ρ为沉积物密度(g·cm-3);t为时间(s)。
从图5看出,I和t1/2存在线性关系,与半球形晶核的形成与长大理论相符合,判断锂离子在钨电极上的成核为半球形三维瞬时成核过程。
3 结论
1.金属锂在钨电极上的还原是锂离子一步得电子的可逆反应过程,反应受扩散控制。在熔盐中锂离子扩散系数为1.35×10-8cm2·s-1,在阶跃的沉积电位下,扩散系数为0.75×10-8cm2·s-1,扩散系数降低44.4%,成核过程为半球形三维瞬时成核。
2.循环伏安研究表明,在氯气析出峰前的氧化特征峰为加入碳酸锂的结果,并且实际析出电位减小了0.5 V(vs Ag/Ag Cl),电场作用下促进了碳酸锂的热分解过程。
参考文献
[1] Yang B,Dai Y N,Wang D J.Preparation and application of lithium metal[J].Journal of Kunming University of Science and Technology,1996,21(6):42.(杨斌,戴永年,王达健.金属锂的制备及应用[J].昆明理工大学学报,1996,21(6):42.)
[2] Zhang M J,Guo Q F.The twenty-first century energy metal-metallurgy research and development of lithium[J].Saline Lake,2001,9(3):52.(张明杰,郭清富.21世纪的能源金属——锂的冶金现状及发展[J].盐湖研究,2001,9(3):52.)
[3] Di X L,Pang Q S,Li Q.The comparison and analysis of extraction process of lithium metal[J].Saline Lake,2005,13(2):45.(狄晓亮,庞全世,李权.金属锂提取工艺比较分析[J].盐湖研究,2005,13(2):45.)
[4] Kipouros G J,Sadoway D R.Toward new technologies for the production of lithium[J].JOM,1998,50(5):24.
[5] Chen Y X.Research process of preparation of rare earth metals by electrolysis in fluoride salt system[J].Rare Earth,2014,35(2):99.(陈宇昕.氟化物体系电解稀土氧化物制备稀土金属研究[J].稀土,2014,35(2):99.)
[6] Lu J L,Wang L,Li J D,Wang Y Y,Li S L,C X Q.Pd-Au nano-catalysts synthesized by electrodeposition and its catalytic performance for methanol[J].Chinese Journal of Rare Metals,2015,39(6):493.(路金林,王琳,李继东,王一雍,李胜利,崔小强.电沉积法制备钯金纳米催化剂及其对甲醇催化性能的研究[J].稀有金属,2015,39(6):493.)
[7] Gao B L,Wang S Q,Gao W J,Shi Z N,Hu X W,Wang Z W.Electrolytic production of Al-Cu-Li master alloy from fluoride melts[J].Rare Metals,2009,28(10):209.
[8] Li J D,Zhang M J,Zhang T A,Li D,Zhang Z.Prep-aration of Al-Li master alloy by molten salt electrolysis[J].Chinese Journal of Nonferrous Metals,2008,18(8):1555.(李继东,张明杰,张廷安,李丹,张卓.熔盐电解法制备铝锂中间合金[J].中国有色金属学报,2008,18(8):1555.)
[9] Li J D,Zhang B G,Zhang M J,Zhang T A.Analysis and calculation of anodic kinetic parameters for process of preparation of Al-Li alloys by molten salt electrolysis[J].Journal of Materials and Metallurgy,2014,13(3):225.(李继东,张保国,张明杰,张廷安.熔盐电解制备铝锂合金中阳极过程动力学参数的分析与计算[J].材料与冶金学报,2014,13(3):225.)
[10] Nohira T,Yasuda K,Ito Y.Pinpoint and bulk electrochemical reduction of insulating silicon dioxide to silicon[J].Natural Materials,2003,2(6):397.
[11] Liang Y J,Che Y C.Inorganic Thermodynamic Data Handbook[M].Shenyang:Northeastern University Press,1993.66.(梁英教,车荫昌.无机热力学数据手册[M].沈阳:东北大学出版社,1993.66.)
[12] Zhang B G,Li J D,Wang Y Y,Zhang M J.Study on current efficiency and the back EMF of the preparation process of Al-Mg alloy by molten salt electrolysis[J].Nonferrous Metal(Metallurgy),2015,17(3):57.(张保国,李继东,王一雍,张明杰.熔盐电解法制备铝镁合金过程电流效率和反电动势研究[J].有色金属(冶炼部分),2015,17(3):57.)
[13] Zhang B G,Li J D,Cao W L,Zhang T A,Wang Y Y.Preparation of Al-Ca alloy by molten-salt electrolysis and its electrode process[J].Nonferrous Metal(Metallurgy),2014,16(9):59.(张保国,李继东,曹文亮,张廷安,王一雍.熔盐电解氧化钙制备铝钙合金及其电极过程分析[J].有色金属(冶炼部分),2014,16(9):59.)
[14] Bard A J,Faulkner L R.The Principle and Application of Electrochemical Methods(Second Edition)[M].Beijing:Chemical Industry Press,2005.156.(巴德,福克纳.电化学方法原理和应用(第二版)[M].北京:化学工业出版社,2005.156.)
[15] Cha Q X.Introduction of the Electrode Process Kinetics[M].Beijing:Metallurgical Industry Press,2003.72.(查全性.电极过程动力学导论[M].北京:冶金工业出版社,2003.72.)
[16] Hills G J,Schiffrin D J,Thompson J.Electrochemical nucleation from molten salts—I.Diffusion controlled electrodeposition of silver from alkali molten salts[J].Electrochemica Acta,1974,19(11):657.