Al-Na2SiO3聚合物抑制剂在白钨矿与方解石浮选分离中的作用机理
来源期刊:中国有色金属学报2020年第12期
论文作者:卫召 孙伟 韩海生 王若林 李爱民 杨美情 黄景华
文章页码:3006 - 3018
关键词:Al-Na2SiO3聚合物抑制剂;Pb-BHA配合物捕收剂;白钨矿;浮选;硅酸钠
Key words:Al-Na2SiO3polymer depressant; Pb-BHA complexes collector; scheelite; flotation; sodium silicate
摘 要:研究了Al3+与硅酸胶粒自组装得到的Al-Na2SiO3聚合物抑制剂在苯甲羟肟酸铅(Pb-BHA)配合物捕收剂体系下对白钨矿与方解石选择性抑制作用机理。单矿物浮选实验结果表明,Al-Na2SiO3可以实现白钨矿与方解石的高效浮选分离。红外光谱和溶液化学分析表明,Al3+与硅酸通过化学成键作用生成具有Si—O—Al 键的铝硅聚合物。动电位测试、X射线光电子能谱(XPS)测试等分析表明,Al-Na2SiO3在白钨矿及方解石表面均发生化学吸附,Al-Na2SiO3中的氧原子和矿物表面的钙质点为吸附反应的活性位点。相比于Na2SiO3,Al-Na2SiO3在白钨矿表面吸附量较少,其化学吸附作用相对较弱,而在方解石的表面吸附量较大,化学吸附作用较强。Al-Na2SiO3聚合物和Pb-BHA配合物选择性的协同作用实现了白钨矿与方解石的高效浮选分离。
Abstract: The mechanism of selective inhibition of scheelite and calcite using Pb-BHA complexes and Al-Na2SiO3polymer self-assembled by Al3+ and colloidal silicic acid as collector and depressant was studied. The flotation results indicate that the separation of scheelite from calcite can be realized by Al-Na2SiO3. The infrared spectroscopy and solution chemical analysis results show that Al3+ and silicate acid form aluminosilicate polymer with Si—O—Al bond via chemical bonding. Zeta potential and XPS analysis results show that calcium cations of scheelite and calcite surfaces could bond to oxygen atoms of Al-Na2SiO3 through chemisorption, the calcium cations and oxygen atoms are the active site of the adsorption reaction. Compared with Na2SiO3, Al-Na2SiO3 shows less adsorption amount and weaker chemisorption on the scheelite surface, while the reverse is true on the calcite surface. The selective separation of scheelite from calcite is attributed to the cooperative selectivity of the Pb-BHA complexes and Al-Na2SiO3 polymer.
DOI: 10.11817/j.ysxb.1004.0609.2020-39673
卫 召1, 2,孙 伟1, 2,韩海生1, 2,王若林1, 2,李爱民3,杨美情3,黄景华3
(1. 中南大学 资源加工与生物工程学院,长沙 410083;
2. 中南大学 战略含钙矿物资源清洁高效利用湖南省重点实验室,长沙 410083;
3. 宁化行洛坑钨矿有限公司,三明 365400)
摘 要:研究了Al3+与硅酸胶粒自组装得到的Al-Na2SiO3聚合物抑制剂在苯甲羟肟酸铅(Pb-BHA)配合物捕收剂体系下对白钨矿与方解石选择性抑制作用机理。单矿物浮选实验结果表明,Al-Na2SiO3可以实现白钨矿与方解石的高效浮选分离。红外光谱和溶液化学分析表明,Al3+与硅酸通过化学成键作用生成具有Si—O—Al 键的铝硅聚合物。动电位测试、X射线光电子能谱(XPS)测试等分析表明,Al-Na2SiO3在白钨矿及方解石表面均发生化学吸附,Al-Na2SiO3中的氧原子和矿物表面的钙质点为吸附反应的活性位点。相比于Na2SiO3,Al-Na2SiO3在白钨矿表面吸附量较少,其化学吸附作用相对较弱,而在方解石的表面吸附量较大,化学吸附作用较强。Al-Na2SiO3聚合物和Pb-BHA配合物选择性的协同作用实现了白钨矿与方解石的高效浮选分离。
关键词:Al-Na2SiO3聚合物抑制剂;Pb-BHA配合物捕收剂;白钨矿;浮选;硅酸钠
文章编号:1004-0609(2020)-12-3006-12 中图分类号:TD952 文献标志码:A
白钨矿作为一种主要的含钨矿物,在选矿中常采用浮选的方法进行回收。然而白钨矿与方解石、萤石等含钙脉石矿物紧密共生,由于表面物理化学性质相近,在浮选中表现出相似的浮选行为,导致白钨矿与含钙脉石矿物的浮选分离一直是选矿领域的世界性难题[1-3]。提高捕收剂的选择性捕收能力和抑制剂的选择性抑制能力,是白钨矿浮选药剂的两个重点研究方向。前期研究表明新型苯甲羟肟酸铅(Pb-BHA)金属有机配合物捕收剂具有很高的选择性,可以实现黑白钨矿的常温混合浮选[4-7]。然而,Pb-BHA配合物捕收剂对于白钨矿与方解石的浮选分离依然较为困难[8-9]。为进一步提高白钨矿与方解石的浮选分离效率,获得更高品质的白钨精矿,需要在Pb-BHA配合物捕收剂的基础上研究高选择性抑制剂。
硅酸钠是白钨矿浮选最为常用的抑制剂,其水溶液俗称为水玻璃。许多学者将水玻璃应用在钨矿浮选中,可以取得良好的分选效果。然而,当矿物组成复杂时,单一水玻璃的选择性往往较差,在抑制方解石和萤石等脉石矿物的同时,也对白钨矿产生了一定程度的影响,这制约了白钨矿回收率的提高[4, 10-11]。因此,在生产实践中,常使用一些方法改性水玻璃,以加强其选择性抑制能力。盐化水玻璃(即金属离子改性水玻璃)与酸化水玻璃是水玻璃改性最为常用的两个方向[12-14],其中金属离子改性水玻璃的效果往往更为突出。文献中报道了以Fe2+[15-17]、Pb2+[18]、Al3+[19]等金属离子与水玻璃混合后的胶体作为方解石的抑制剂,结果表明,金属离子的加入显著提高了水玻璃的选择性[12]。相关学者对于金属离子改性水玻璃的机理做了一些研究,其主要观点有两种:一种认为金属离子的加入会促进体系的水解从而产生大量的硅酸胶体,这种硅酸胶粒具有很高的活性和选择性;而另一种认为水玻璃是和金属离子发生了化学反应生成某种复合硅酸盐胶体,这种硅酸盐胶体活性更高,在矿物表面吸附的选择性抑制作用更强[16, 20-21]。显然这两种理论对于金属离子在改性水玻璃过程中的作用机理存在一定的偏差,金属离子进入水玻璃后对水玻璃结构的影响尚缺乏深入研究。盐化水玻璃在矿物表面的吸附方式、作用位点以及其在不同矿物表面的吸附差异也缺乏全面的研究与讨论。因此,研究盐化水玻璃的结构与性质、在白钨矿与方解石浮选中的行为及在两种矿物表面选择性吸附的机理,对于其实践应用具有重要的现实意义。
本文以Al3+和硅酸钠自组装生成的Al-Na2SiO3聚合物作为抑制剂,研究其在白钨矿与方解石浮选分离中的行为及作用机理。通过单矿物浮选试验,考察了Al-Na2SiO3在Pb-BHA配位捕收剂体系下对白钨矿 与方解石浮选分离的影响。并通过动电位测试、红外光谱测试、X射线光电子能谱测试等分析检测方法,研究了Al3+与Na2SiO3在溶液中的自组装机理、Al-Na2SiO3在矿物表面吸附作用机理,以及Al-Na2SiO3在矿物表面对Pb-BHA吸附的影响。
1 实验
1.1 试验样品及试剂
试验所用的白钨矿、方解石和萤石的单矿物样品取自湖南柿竹园有色金属有限责任公司。块状的单矿物经手选、粗碎、细磨,得到粒度小于0.074 mm的纯矿物,供浮选实验及XPS检测使用。一部分矿样细磨到粒度小于2 μm供动电位测试使用。制备好的矿样经X射线衍射和化学元素分析,表明三种单矿物纯度均在98.0%以上,符合单矿物试验的试样纯度的要求。
试验所用硝酸铅、苯甲羟肟酸(BHA)、硅酸钠、硫酸铝、氢氧化钠和盐酸均为分析纯,起泡剂松油醇为化学纯。pH值由NaOH和HCl溶液进行调节。试验用水均为去离子水。
1.2 浮选试验方法
浮选试验在40 mL容积浮选槽的XFG型挂槽式浮选机中进行,试验转速为1900 r/min,浮选流程如图1所示。单矿物试验中每次称取2.0 g纯矿物样,加入适量去离子水,搅拌1 min,此后按照图1所示的流程依次加入相应的药剂并搅拌一定的时间。人工混合矿为白钨矿和方解石各1.0 g进行均匀混合。其中Al-Na2SiO3使用时需要事前混合加入,硝酸铅与苯甲羟肟酸配合使用时同样需要事先混合后加入,且Al-Na2SiO3和Pb-BHA都采用现配现用的方式。浮选前用PHS-3C精密pH计测量并记录pH值。浮选采用刮板手工刮取浮选泡沫,将泡沫精矿和过滤后的尾矿烘干并称量,最后计算回收率。每组实验取三次试验的平均值作为最终的浮选回收率。
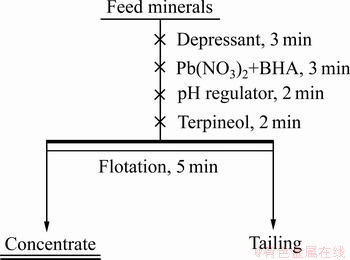
图1 单矿物浮选流程图
Fig. 1 Flowsheet of pure mineral flotation test
1.3 Zeta电位测定
取20 mg粒度为小于2 μm的单矿物样品,加KCl电解液(1×10-3 mol/L) 配制成40 mL的矿浆后于磁力搅拌器搅拌,加入相应药剂后用HCl或Na2CO3调节pH值,静置10 min后用取矿浆的澄清液注入动电位专用测试管进行测试。药剂的动电位测试则直接配制相应浓度的药剂,调节pH值后静置10 min待测试。测量过程中对每个条件取3次测量的平均值作为测量结果,误差范围在5%以内。
1.4 红外光谱测试及X射线光电子能谱测试
称取 1 g 粒级小于2 μm的单矿物矿样于40 mL水溶液的浮选槽中,参照单矿物浮选试验流程依次加入相应药剂并调节pH值为8.0左右,搅拌30 min后过滤,经pH=8.0的去离子水溶液冲洗矿物2~3次,真空干燥后进行检测。采用溴化钾压片法进行红外光谱测试,分析波数范围为 4000~400 cm-1,记录试验数据。光电子能谱仪X射线源为Al Kα微聚集单色器,工作电压为12000 V,仪器分辨率为0.50 eV,误差为±0.2 eV,测试结果采用XPS peak 进行分峰拟合。
2 结果与讨论
2.1 Al-Na2SiO3聚合物抑制剂对含钙矿物浮选行为的影响
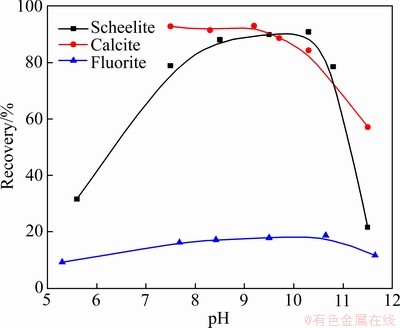
图2 Pb-BHA配合物捕收剂体系下白钨矿、方解石和萤石的可浮性
Fig. 2 Floatability of scheelite, calcite and fluorite with Pb-BHA as collector (cPb=3×10-4 mol/L, cBHA=1.5×10-4 mol/L, φterpineol=12.5 μL/L)
Pb-BHA配合物捕收剂对白钨矿、方解石和萤石的捕收能力如图2所示。由图2可知,当Pb-BHA配合物作为捕收剂时,萤石的回收率低于20%,这表明Pb-BHA配合物对萤石几乎没有捕收能力。但在pH为8.0~10.5的浮选范围内,白钨矿和方解石的浮选回收率都大于80%,这表明Pb-BHA配合物对白钨矿和方解石均具有较强的捕收能力,在没有抑制剂的情况下无法实现两种矿物的浮选分离。
实验中考察了不同用量的Na2SiO3对白钨矿和方解石浮选回收率的影响,结果如图3(a) 所示。结果表明,随着硅酸钠用量的不断增加,白钨矿的浮选回收率呈现出先下降、后上升、再下降的“波浪曲线”,但整体呈现明显的下降趋势,这表明硅酸钠对白钨矿的浮选表现出了十分明显的抑制作用。而方解石回收率的降低幅度相对较小,方解石的浮选回收率基本上始终高于白钨矿,这表明硅酸钠无法实现白钨矿与方解石的浮选分离。以Na2SiO3与Al3+质量比2:1配制Al-Na2SiO3聚合物抑制剂,考察不同用量的Al-Na2SiO3对白钨矿和方解石浮选回收率的影响,结果如图3(b) 所示。结果表明,Al-Na2SiO3对于白钨矿的浮选回收率同样出现了“波浪曲线”,但曲线的高点范围变得更宽。当Al-Na2SiO3浓度为100 mg/L时,白钨矿的回收率达到85.58%的峰值。这表明Al-Na2SiO3对于白钨矿的抑制作用相比硅酸钠的要明显减弱。而Al-Na2SiO3对于方解石浮选表现出了很强的抑制能力,在100 mg/L的最佳用量时,方解石回收率仅为27.59%。因此,在Al-Na2SiO3用量达到60 mg/L以上时,白钨矿的浮选回收率将会明显高于方解石,出现了两者的分离区间,可以实现白钨矿与方解石的浮选分离。
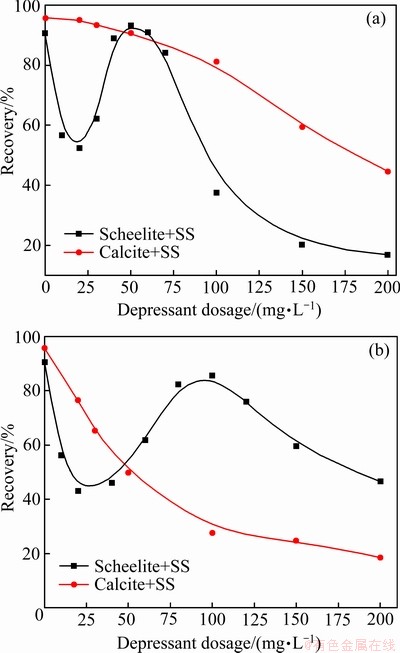
图3 Na2SiO3及Al-Na2SiO3用量对白钨矿及方解石浮选的影响
Fig. 3 Effect of Na2SiO3(a) and Al-Na2SiO3(b) polymer dosages on scheelite and calcite flotation (pH=9.0±0.1, cPb=3×10-4 mol/L, cBHA=1.5×10-4 mol/L, φterpineol=12.5 μL/L)
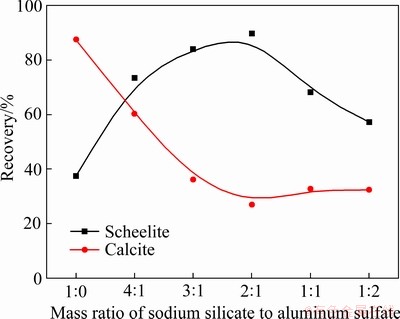
图4 硅酸钠与硫酸铝的质量比对白钨矿和方解石浮选回收率的影响
Fig. 4 Effect of mass ratio of sodium silicate to aluminum sulfate on scheelite and calcite flotation recovery (pH=8.0±0.1, ρSS=100 mg/L, cPb=3×10-4 mol/L, cBHA=1.5×10-4 mol/L, φterpineol=12.5 μL/L)
为了进一步优化Al-Na2SiO3的选择性,探究了硅酸钠与硫酸铝的质量比对白钨矿和方解石浮选回收率的影响,结果如图4所示,其中硅酸钠的用量固定为100 mg/L。结果表明,白钨矿和方解石的浮选回收率随铝离子浓度的增加而变化,铝离子的加入显著提高了白钨矿和方解石的选择性。但是过量的铝离子会对白钨矿浮选产生不利影响,因此,硅酸钠与硫酸铝的最佳配比为2:1(质量比)。
不同pH值条件下Al-Na2SiO3聚合物抑制剂对白钨矿和方解石浮选的影响如图5所示。由图5可知,在pH值为7.0~9.0时,白钨矿的回收率高于80%,此时方解石的回收率仅为20%~30%。在pH值为8.0时,白钨矿和方解石的回收率分别为89.8%和27%,取得最大的回收率差值。这表明在pH=8.0、Al-Na2SiO3用量为100 mg/L时,Al-Na2SiO3聚合物可以实现白钨矿与方解石的高效浮选分离。
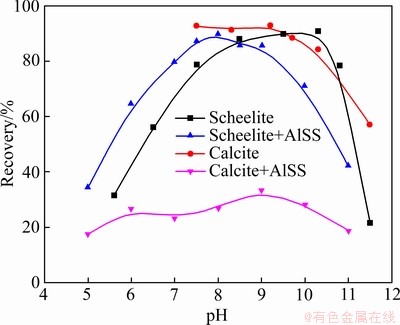
图5 不同pH条件下Al-Na2SiO3聚合物抑制剂对白钨矿和方解石浮选的影响
Fig. 5 Effect of Al-Na2SiO3 polymer on scheelite and calcite flotation with varying pH (ρAlSS=100 mg/L, cPb=3×10-4 mol/L, cBHA=1.5×10-4 mol/L, φterpineol=12.5 μL/L)
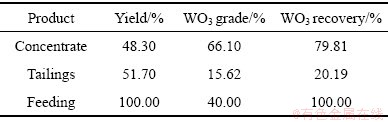
在上述实验确定的最佳浮选条件下,对白钨矿和方解石的混合矿进行了浮选试验。表1所示为混合矿的浮选试验结果。由表1可知,通过Al-Na2SiO3用的选择性抑制作用,可以获得WO3品位为66.10%的精矿,回收率为79.81%。这表明Al-Na2SiO3聚合物在白钨矿与方解石的混合体系中具有良好的选择性。
表1 混合矿的浮选试验结果
Table 1 Flotation results from mixed minerals
2.2 Al-Na2SiO3聚合物抑制剂的结构及自组装机理
2.2.1 Al-Na2SiO3聚合物抑制剂的红外光谱研究
通过红外光谱对Al-Na2SiO3聚合物的结构进行分析,Na2SiO3及Al-Na2SiO3的红外光谱如图6所示。Na2SiO3的红外光谱图中,3324.73 cm-1和3396.63 cm-1吸收谱带为分子间缔合羟基振动吸收峰,990.71 cm-1和460.92 cm-1分别为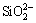 离子Si—O—Si伸缩振动峰和
离子Si—O—Si伸缩振动峰和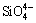 离子中Si—O—Si弯曲振动峰[22-23]。而在Al-Na2SiO3聚合物的红外光谱图中,出现了2520.54 cm-1、586.26 cm-1两个新的吸收峰,同时2954.46 cm-1、2328.51 cm-1、1454.20 cm-1等几个吸收峰消失,其余的峰发生了不同程度的位移,这表明Al3+与Na2SiO3的反应使得硅酸钠的结构发生了一定程度的变化。其中2520.54 cm-1处的吸收峰主要是O—Al 键合的结果,1105.02 cm-1和445.14 cm-1处的吸收峰是Si—O—Al 振动所产生,586.26 cm-1处的吸收峰属于Al—OH 的弯曲振动[24-26]。所以,通过这些峰强度的变化可以看出铝离子与硅酸钠反应后,铝离子与Si—O键发生了成键作用,从而出现了Si—O—Al的键合。因此,红外光谱图的对比分析结果表明,铝离子与Na2SiO3的反应使得硅酸钠的结构发生了变化,Si—O—Al 振动峰的出现说明铝离子与硅酸钠不是简单的复合,而是通过化学键合生成了更稳定的Al-Na2SiO3聚合物。
离子中Si—O—Si弯曲振动峰[22-23]。而在Al-Na2SiO3聚合物的红外光谱图中,出现了2520.54 cm-1、586.26 cm-1两个新的吸收峰,同时2954.46 cm-1、2328.51 cm-1、1454.20 cm-1等几个吸收峰消失,其余的峰发生了不同程度的位移,这表明Al3+与Na2SiO3的反应使得硅酸钠的结构发生了一定程度的变化。其中2520.54 cm-1处的吸收峰主要是O—Al 键合的结果,1105.02 cm-1和445.14 cm-1处的吸收峰是Si—O—Al 振动所产生,586.26 cm-1处的吸收峰属于Al—OH 的弯曲振动[24-26]。所以,通过这些峰强度的变化可以看出铝离子与硅酸钠反应后,铝离子与Si—O键发生了成键作用,从而出现了Si—O—Al的键合。因此,红外光谱图的对比分析结果表明,铝离子与Na2SiO3的反应使得硅酸钠的结构发生了变化,Si—O—Al 振动峰的出现说明铝离子与硅酸钠不是简单的复合,而是通过化学键合生成了更稳定的Al-Na2SiO3聚合物。
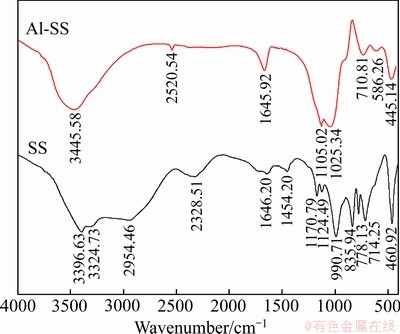
图6 Na2SiO3及Al-Na2SiO3的红外光谱图
Fig. 6 Infrared spectra of Na2SiO3 and Al-Na2SiO3 polymer
2.2.2 Al-Na2SiO3聚合物抑制剂的溶液化学反应分析
硅酸钠属于强碱弱酸盐,在水溶液中会发生一系列的水解反应,生成各种组分的水解产物。硅酸钠在不同的 pH 条件下,水解和电离反应的方向也会发生变化,溶液中所形成的主要组分也会随之发生变化。硅酸钠组分分布与pH的关系如图7(a)所示,可知在碱性环境下,9.4≤pH<12.6时, 占优势、pH≥12.6时,
占优势、pH≥12.6时, 占优势,而当 pH<9.4,溶液中Si(OH)4主要组分[27]。铝盐加入水溶液中后,Al3+会发生逐级水解反应。铝离子组分分布与pH的关系如图7(b)所示,可知在pH在3~5范围内,[Al(H2O)6]3+、[Al(H2O)5OH]2+、[Al(H2O)4(OH)2]+等单体羟基络合离子组分占优,在pH在7~8范围内,Al(OH)3组分占优,在pH>9时,
占优势,而当 pH<9.4,溶液中Si(OH)4主要组分[27]。铝盐加入水溶液中后,Al3+会发生逐级水解反应。铝离子组分分布与pH的关系如图7(b)所示,可知在pH在3~5范围内,[Al(H2O)6]3+、[Al(H2O)5OH]2+、[Al(H2O)4(OH)2]+等单体羟基络合离子组分占优,在pH在7~8范围内,Al(OH)3组分占优,在pH>9时,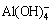 占优[28-29]。
占优[28-29]。
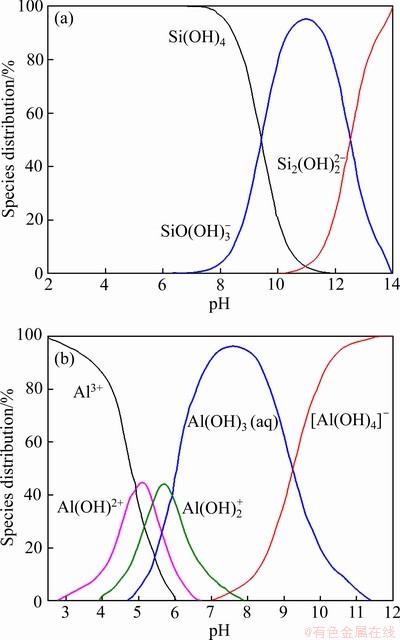
图7 硅酸钠组分和铝离子组分分布与pH的关系
Fig. 7 Speciation distribution of sodium silicate (a) and monomer aluminum (b) anions as function of pH (c=1×10-4 mol/L)
当Al3+加入硅酸钠溶液中,单体铝水解产物会与硅酸或聚硅酸表面或结构中的羟基发生脱水缩聚或脱羟基反应形成新的复合铝硅酸聚合物。在碱性环境下,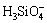 和
和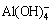 在溶液中均为优势组分,推测两者可按照如图8中的反应进行脱羟基缩聚。单体铝羟基络合离子与硅酸组分的综合作用结果是体系中出现了
在溶液中均为优势组分,推测两者可按照如图8中的反应进行脱羟基缩聚。单体铝羟基络合离子与硅酸组分的综合作用结果是体系中出现了
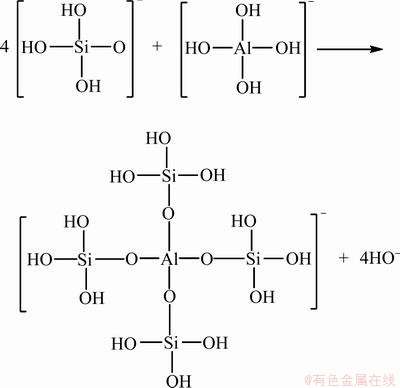
图8 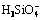 和
和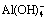 的脱羟基反应
的脱羟基反应
Fig. 8 Dehydroxylation condensation reaction between 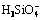 and
and 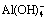
Si—O—Al 键,硅氧四面体和铝氧四面体以氧原子为桥梁形成三维网状结构的复合铝硅酸聚合物,这和红外光谱的检测结果相符。与硅酸钠相比,Al-Na2SiO3的结构发生了变化,其溶液组分更加复杂,聚合物胶团分子量更大,物理化学性质也发生了一定的变化。
2.3 Al-Na2SiO3聚合物抑制剂在矿物表面的吸附作用机理
2.3.1 动电位测试分析
为了对Al-Na2SiO3在矿物表面的吸附进行研究,测定了Na2SiO3及Al-Na2SiO3在溶液中的Zeta电位,结果如图9所示。结果表明,在pH为7~11的常规白钨矿浮选pH范围内,Al-Na2SiO3的电位更负。这可能是由于铝离子与硅酸钠的自组装反应使得硅酸钠聚合成为分子量更大的聚合物,Al-Na2SiO3的表面羟基基团变多,使得聚合物表面电位更负。因此,Al-Na2SiO3可能比Na2SiO3更难以吸附在带负电荷的白钨矿石表面。
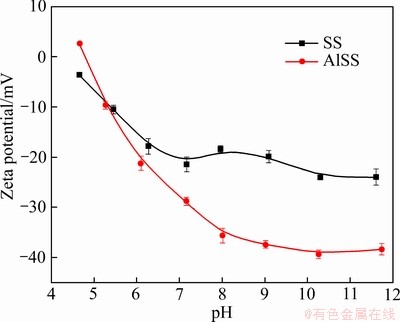
图9 Na2SiO3和Al-Na2SiO3的Zeta电位与pH的关系
Fig. 9 Zeta potentials of Na2SiO3 and Al-Na2SiO3 (ρSS=ρAlSS=100 mg/L) as function of pH
Na2SiO3和Al-Na2SiO3的用量对白钨矿和方解石的动电位的影响如图10所示。从图10(a)可以看出,Al-Na2SiO3处理过后白钨矿的Zeta电位下降幅度小于Na2SiO3,说明Al-Na2SiO3对白钨矿的吸附作用较小。而图10(b)表明,Al-Na2SiO3的加入导致方解石的Zeta电位迅速降低,这说明Al-Na2SiO3对方解石的吸附作用更强。因此,Al-Na2SiO3对方解石的吸附较强,对白钨矿的吸附较弱,这与浮选结果一致。
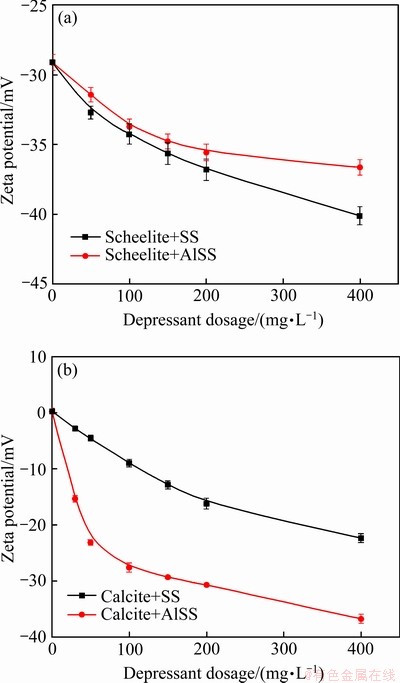
图10 Na2SiO3和Al-Na2SiO3的用量对白钨矿和方解石Zeta电位的影响
Fig. 10 Effect of depressant dosage of Na2SiO3 and Al-Na2SiO3 on Zeta potential of scheelite(a) and calcite(b) (pH=8.0±0.1)
2.3.2 X射线光电子能谱分析
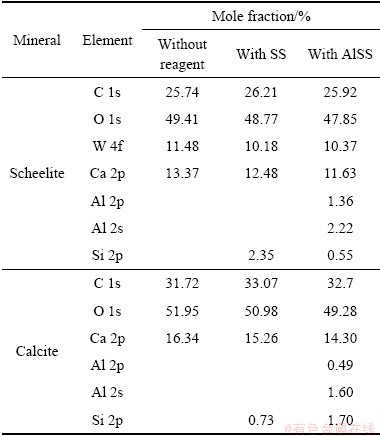
对Na2SiO3及Al-Na2SiO3与白钨矿及方解石作用前后的X射线光电子能谱进行测定和分析。Na2SiO3及Al-Na2SiO3与白钨矿和方解石作用前后表面元素含量如表2所示。结果表明,白钨矿与Na2SiO3及Al-Na2SiO3作用后,表面Si元素含量分别为2.35%和0.55%,这表明Al-Na2SiO3在白钨矿表面的吸附量相对较低。而Na2SiO3及Al-Na2SiO3与方解石作用后表面Si元素含量分别为0.73%和1.70%,这表明Al-Na2SiO3在方解石表面的吸附量相对较高。
表2 白钨矿及方解石与药剂作用前后表面元素含量变化
Table 2 Atomic concentration of elements on scheelite and calcite surfaces with/without reagents
为了进一步研究药剂与白钨矿的作用机理,对Na2SiO3及Al-Na2SiO3与白钨矿作用前后Ca 2p和O 1s结合能谱进行分峰拟合,其结果如图11所示。白钨矿Ca 2p1和Ca 2p3两个钙结合能峰值分别在350.51 eV和346.95 eV,O 1s分为两个峰位,532.39 eV和530.41 eV结合能峰值分别对应CaWO4中Ca—O键和W—O键对应的结合能[30-32]。白钨矿与硅酸钠作用后,Ca 2p1和Ca 2p3两个钙结合能峰值发生了0.16 eV和0.14 eV的位移,O 1s的两个结合能峰值发生了0.29 eV和0.11 eV的位移。而Al-Na2SiO3与白钨矿作用后,Ca 2p1和Ca 2p3两个钙结合能峰值发生了0.09 eV和0.07 eV的位移,O 1s的两个结合能峰值发生了0.12 eV和0.14 eV的位移。这表明Al-Na2SiO3对白钨矿Ca 2p和O 1s的影响较小。而Ca质点和Ca—O键结合能更为显著的位移表明药剂与白钨矿的作用是以矿物表面钙质点为活性位点,Na2SiO3及Al-Na2SiO3中Si—O键中的氧与白钨矿表面钙质点发生化学键合,在矿物表面生成了新的Ca—O键,因此,Na2SiO3及Al-Na2SiO3在白钨矿表面的吸附均为化学吸附。同时,相比于Na2SiO3,Al-Na2SiO3对白钨矿表面Ca 2p1、Ca 2p3和O 1s中Ca—O键结合能的影响相对较小,表明Al-Na2SiO3在白钨矿表面的吸附相对较弱。
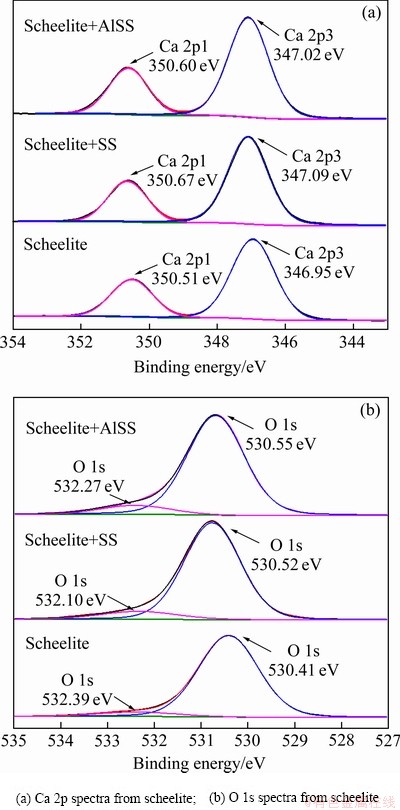
图11 Na2SiO3和Al-Na2SiO3对白钨矿表面Ca 2p和O 1s图谱的影响
Fig. 11 Effects of Na2SiO3 and Al-Na2SiO3 on Ca 2p and O 1s spectra of scheelite surface
对Na2SiO3及Al-Na2SiO3与方解石作用前后Ca 2p和O 1s结合能谱进行分峰拟合,结果如图12所示。由图12可知,方解石Ca 2p1和Ca 2p3两个钙结合能峰值分别在350.67 eV和347.11 eV,O 1s分为两个峰位,533.26 eV和531.50 eV结合能峰值为CaCO3中Ca—O键和C—O键对应的结合能[33-34]。方解石与硅酸钠作用后,其Ca 2p1和Ca 2p3结合能峰值发生了0.07 eV和0.06 eV的位移,其O 1s的两个结合能峰值发生了0.11 eV和0.06 eV的位移。而Al-Na2SiO3与方解石作用后,Ca 2p1和Ca 2p3结合能峰值发生了 0.17 eV和0.17 eV的位移,O 1s的两个结合能峰值发生了0.35 eV和0.18 eV的位移。这表明Al-Na2SiO3对方解石Ca 2p和O 1s结合能影响更为显著。Ca质点和Ca—O键结合能的变化同样表明药剂与方解石的作用是以矿物表面钙质点为活性位点,钙质点与药剂Si—O键中的氧发生化学键合,在矿物表面生成了新的Ca—O键,因此,Na2SiO3及Al-Na2SiO3在方解石表面的吸附同样均为化学吸附。而相比于Na2SiO3,Al-Na2SiO3对方解石表面Ca 2p1、Ca 2p3和O 1s中Ca—O键结合能的影响更为显著,这表明Al-Na2SiO3在方解石表面的吸附相对较强。
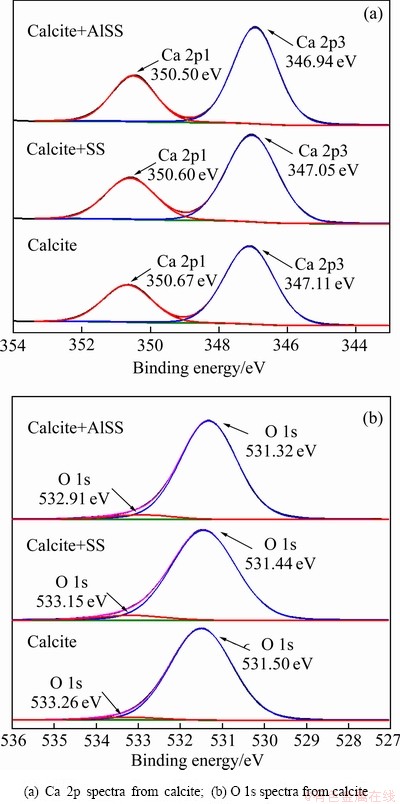
图12 Na2SiO3和Al-Na2SiO3对方解石表面Ca 2p和O 1s图谱的影响
Fig. 12 Effects of Na2SiO3 and Al-Na2SiO3 on Ca 2p and O 1s spectra of calcite surface
2.4 Al-Na2SiO3聚合物抑制剂的吸附对Pb-BHA配合物捕收剂吸附的影响
Al-Na2SiO3抑制剂在矿物表面的吸附也会对Pb-BHA配合物捕收剂的吸附产生不同的影响。研究表明,Pb-BHA胶粒的电位在pH值4~12的范围内均为正,胶粒带有很强的正电荷[5]。探究了不同浓度的Pb-BHA对经过Na2SiO3和Al-Na2SiO3聚合物处理后的白钨矿和方解石Zeta电位的影响,其结果如图13所示。结果表明白钨矿和方解石的Zeta电位随Pb-BHA用量的增加而增大,说明Pb-BHA在矿物表面发生了吸附。从图13(a)可以看出,Al-Na2SiO3处理的白钨矿的Zeta电位较Na2SiO3处理的白钨矿的Zeta电位明显增大,说明Al-Na2SiO3聚合物处理后,白钨矿表面吸附的Pb-BHA比吸附的Na2SiO3多。然而,方解石的情况正好相反,如图13(b)所示,Al-Na2SiO3处理的方解石的Zeta电位较Na2SiO3处理的白钨矿的Zeta电位明显降低。因此,Al-Na2SiO3聚合物对白钨矿表面Pb-BHA配合物的吸附影响较小,而对方解石表面的吸附影响明显。
基于上述分析结果,建立了Al-Na2SiO3聚合物和Pb-BHA配合物在白钨矿和方解石表面的吸附模型,如图14所示。Pb-BHA胶体在溶液中带强正电,其与矿物表面的作用是通过铅离子基团识别矿物表面氧原子来实现化学吸附[6]。而Al-Na2SiO3胶体在溶液中带强负电,通过其氧原子与矿物表面的钙原子的键合来实现化学吸附。白钨矿的常见解理面整体上暴露出较多的氧原子,由于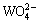 占优势,导致其表面带负电荷,因此,强正电荷的Pb-BHA更容易与白钨矿表面的氧原子发生吸附。而方解石的常见解理面暴露出更多的钙原子,Ca2+占优导致在pH值为7~9的条件下方解石表面带正电荷,因此,Pb-BHA在方解石表面的吸附是不利的。另一方面,带强负电荷的Al-Na2SiO3在带负电荷的富氧白钨矿表面的吸附相对困难,其化学吸收作用较弱,吸附量较少。然而,Al-Na2SiO3更倾向于在带正电的富钙方解石表面吸附,其化学吸收作用较强,吸附量较大。这使得Al-Na2SiO3作为抑制剂在白钨矿和方解石浮选中表现出很强的选择性。当以Pb-BHA配合物为捕收剂,以Al-Na2SiO3聚合物为抑制剂,来浮选分离白钨矿和方解石时,两种药剂的选择性被充分发挥并相互增强。白钨矿表面吸附了较多的Pb-BHA和较少的Al-Na2SiO3,使其具有较强的疏水性,从而粘附气泡上浮成为精矿。而方解石表面吸附了较少的Pb-BHA和较多的Al-Na2SiO3,使其具有很强的亲水性,进而留在矿浆中成为尾矿。因此,通过Pb-BHA配合物与Al-Na2SiO3聚合物的协同选择性实现了白钨与方解石的选择性高效分离。
占优势,导致其表面带负电荷,因此,强正电荷的Pb-BHA更容易与白钨矿表面的氧原子发生吸附。而方解石的常见解理面暴露出更多的钙原子,Ca2+占优导致在pH值为7~9的条件下方解石表面带正电荷,因此,Pb-BHA在方解石表面的吸附是不利的。另一方面,带强负电荷的Al-Na2SiO3在带负电荷的富氧白钨矿表面的吸附相对困难,其化学吸收作用较弱,吸附量较少。然而,Al-Na2SiO3更倾向于在带正电的富钙方解石表面吸附,其化学吸收作用较强,吸附量较大。这使得Al-Na2SiO3作为抑制剂在白钨矿和方解石浮选中表现出很强的选择性。当以Pb-BHA配合物为捕收剂,以Al-Na2SiO3聚合物为抑制剂,来浮选分离白钨矿和方解石时,两种药剂的选择性被充分发挥并相互增强。白钨矿表面吸附了较多的Pb-BHA和较少的Al-Na2SiO3,使其具有较强的疏水性,从而粘附气泡上浮成为精矿。而方解石表面吸附了较少的Pb-BHA和较多的Al-Na2SiO3,使其具有很强的亲水性,进而留在矿浆中成为尾矿。因此,通过Pb-BHA配合物与Al-Na2SiO3聚合物的协同选择性实现了白钨与方解石的选择性高效分离。
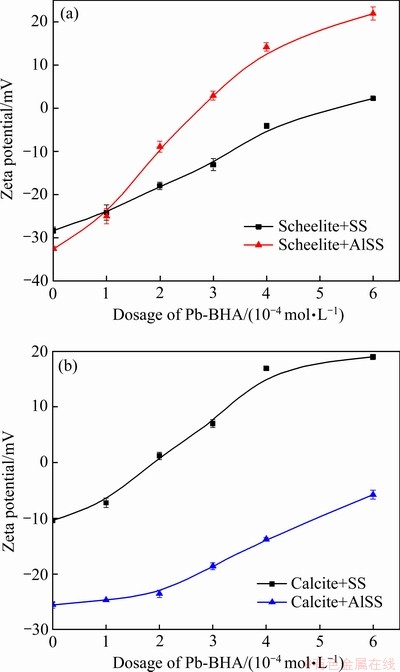
图13 不同浓度的Pb-BHA对经过Na2SiO3和Al-Na2SiO3处理后的白钨矿及方解石Zeta电位的影响
Fig.13 Zeta potential plots for scheelite(a) and calcite(b) at different concentrations of Pb-BHA after treatment with Na2SiO3 and Al-Na2SiO3 polymer (pH=8.0±0.1, cPb:cBHA=2, ρSS=ρAlSS=100 mg/L)
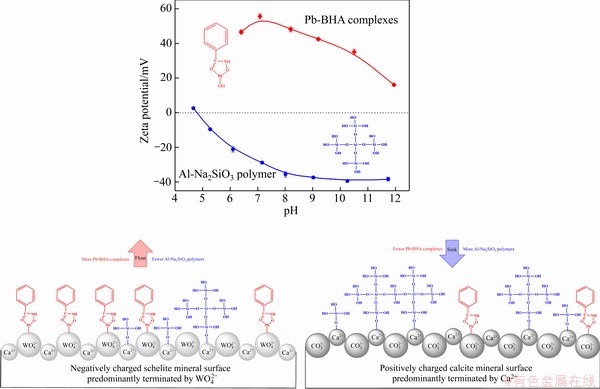
图14 Al-Na2SiO3聚合物和Pb-BHA配合物在白钨矿和方解石表面的吸附模型
Fig. 14 Adsorption model for Al-Na2SiO3 polymer and Pb-BHA complexes on scheelite and calcite surface
3 结论
1) Pb-BHA配位捕收剂对于白钨矿和方解石都具有很强的捕收能力,添加Na2SiO3无法实现白钨矿与方解石的浮选分离,而Al-Na2SiO3可以实现白钨矿与方解石的浮选分离。在Al-Na2SiO3聚合物中硅酸钠和铝离子的质量比为2:1,用量为100 mg/L,pH=8.0的最佳条件下,可以实现白钨矿与方解石的高效浮选分离。
2) Al-Na2SiO3的自组装机理是Al3+水解产物与硅酸组分通过化学成键作用生成的具有Si—O—Al 键的铝硅聚合物。与硅酸钠相比,Al-Na2SiO3聚合物胶团分子量更大,物理化学性质也发生了一定程度的变化。
3) Al-Na2SiO3在白钨矿及方解石表面的吸附均为化学吸附,矿物表面的钙和Al-Na2SiO3的Si—O键中的氧为活性位点。相比于Na2SiO3,Al-Na2SiO3在白钨矿表面吸附量较少,吸附作用相对较弱,而在方解石的表面吸附量较大,吸附作用较强。
4) Al-Na2SiO3聚合物对白钨矿表面Pb-BHA配合物的吸附影响较小,而对方解石表面的吸附影响明显。Pb-BHA配位捕收剂和Al-Na2SiO3聚合物抑制剂的组合使用,使得捕收剂与抑制剂的选择性相互得到加强,从而使得白钨矿与方解石的浮选分离取得良好的效果。
REFERENCES
[1] GAO Zhi-yong, HU Yue-hua, SUN Wei, DRELICH J W. Surface-charge anisotropy of scheelite crystals[J]. Langmuir, 2016, 32(25): 6282-6288.
[2] GAO Zhi-yong, LI Cheng-wei, SUN Wei, HU Yue-hua. Anisotropic surface properties of calcite: A consideration of surface broken bonds[J]. Colloids and Surfaces A (Physicochemical and Engineering Aspects), 2017, 520: 53-61.
[3] GAO Zhi-yong, XIE Lei, CUI Xin, HU Yue-hua, SUN Wei, ZENG Hong-bo. Probing anisotropic surface properties and surface forces of fluorite crystals[J]. Langmuir, 2018, 34(7): 2511-2521.
[4] HAN Hai-sheng, HU Yue-hua, SUN Wei, LI Xiao-dong, CAO Chong-gao, LIU Run-qing, YUE Tong, MENG Xiang-song, GUO Yan-zhe, WANG Jian-jun, GAO Zhi-yong, CHEN Pan, HUANG Wei-sheng, LIU Jie, XIE Jia-wen, CHEN Yu-lin. Fatty acid flotation versus BHA flotation of tungsten minerals and their performance in flotation practice[J]. International Journal of Mineral Processing, 2017, 159: 22-29.
[5] HAN Hai-sheng, HU Yue-hua, SUN Wei, LI Xiao-dong, CHEN Ke-feng, ZHU Yang-ge, NGUYEN A V, TIAN Meng-jie, WANG Li, YUE Tong, LIU Run-qing, GAO Zhi-yong, CHEN Pan, ZHANG Chen-hu, WANG Jian-jun, WEI Zhao, WANG Ruo-lin. Novel catalysis mechanisms of benzohydroxamic acid adsorption by lead ions and changes in the surface of scheelite particles[J]. Minerals Engineering, 2018, 119: 11-22.
[6] HAN Hai-sheng, XIAO Yao, HU Yue-hua, SUN Wei, NGUYEN A V, TANG Hong-hu, GUI Xia-hui, XING Yao-wen, WEI Zhao, WANG Jian-jun. Replacing Petrov’s process with atmospheric flotation using Pb-BHA complexes for separating scheelite from fluorite[J]. Minerals Engineering, 2020, 145: 106053.
[7] 胡岳华, 韩海生, 田孟杰, 孙 伟, 王建军, 卫 召, 王若林. 苯甲羟肟酸铅金属有机配合物在氧化矿浮选中的作用机理及其应用[J]. 矿产保护与利用, 2018(1): 42-47, 53.
HU Yue-hua, HAN Hai-sheng, TIAN Meng-jie, SUN Wei, WANG Jian-jun, WEI Zhao, WANG Ruo-lin. The application of metal-coordinated complexes in the flotation of oxide minerals and fundamental research of the adsorption mechanism[J].Conservation and Utilization of Mineral Resources, 2018(1): 42-47, 53.
[8] WANG Ruo-lin, WEI Zhao, HAN Hai-sheng, SUN Wei, HU Yue-hua, WANG Jian-jun, WANG Li, LIU Hang, YANG Yue, ZHANG Chen-yang, HE Jian-yong. Fluorite particles as a novel calcite recovery depressant in scheelite flotation using Pb-BHA complexes as collectors[J]. Minerals Engineering, 2019, 132: 84-91.
[9] 卫 召, 韩海生, 胡岳华, 朱阳戈, 孙 伟, 王建军, 林上勇, 成朋飞, 李成伟, 陈宇枫. Pb-BHA配位捕收剂的黑白钨混合常温浮选研究[J]. 有色金属工程, 2017, 7(6): 70-75.
WEI Zhao, HAN Hai-sheng, HU Yue-hua, ZHU Yang-ge, SUN Wei, WANG Jian-jun, LIN Shang-yong, CHENG Peng-fei, LI Cheng-wei, CHEN Yu-feng. Flotation of wolframite and scheelite at the room temperature based on Pb-BHA coordination collector[J]. Nonferrous Metals Engineering, 2017, 7(6): 70-75.
[10] 王建军, 高志勇, 孙 伟, 刘红尾. 白钨矿常温浮选基础研究[J]. 金属矿山, 2016(2): 66-71.
WANG Jian-jun, GAO Zhi-yong, SUN Wei, LIU Hong-wei. Basic research of scheelte flotation at normal temperature[J]. Metal Mine, 2016(2): 66-71.
[11] KANG Jian-hua, LIU Yuan-chao, AHMED K S, HU Yue-hua, SUN Wei, LIU Run-qing. Significant improvement in the scheelite heating flotation with sodium sulfide[J]. Minerals, 2018, 8: 587.
[12] KUPKA N, RUDOLPH M. Froth flotation of scheelite—A review[J]. International Journal of Mining Science and Technology, 2018, 28(3): 373-384.
[13] YANG Xiao-sheng. Beneficiation studies of tungsten ores—A review[J]. Minerals Engineering, 2018, 125: 111-119.
[14] 李天光, 邱显扬, 周晓彤. 白钨矿浮选药剂研究现状[J]. 材料研究与应用, 2018, 12(1): 8-12.
LI Tian-guang, QIU Xian-yang, ZHOU Xiao-tong. Research status of scheelite flotation reagents[J]. Materials Research and Application, 2018, 12(1): 8-12.
[15] HU Yuan, HUANG Yu-qing, DENG Rong-dong, MA Lin, YIN Wan-zhong. Improvement effect of FeSO4·7H2O on flotation separation of scheelite from fluorite[J]. ACS Omega, 2019, 4(7): 11364-11371.
[16] DENG Rong-dong, YANG Xiao-feng, HU Yuan, KU Jian-gang, ZUO Wei-ran, MA Ying-qiang. Effect of Fe(II) as assistant depressant on flotation separation of scheelite from calcite[J]. Minerals Engineering, 2018, 118: 133-140.
[17] OLIVEIRA J F, SAMPAIO J A. Development studies for the recovery of Brazilian scheelite fines by froth flotation[M]. Amsterdam: Production and Processing of Fine Particles, 1988: 209-217.
[18] FENG Bo, GUO Wei, XU Hong-guo, PENG Jin-xiu, LUO Xian-ping, ZHU Xian-wen. The combined effect of lead ion and sodium silicate in the flotation separation of scheelite from calcite[J]. Separation Science and Technology, 2016, 52(3): 567-573.
[19] TIAN Jia, XU Long-hua, SUN Wei, ZENG Xiao-bo, FANG Shuai, HAN Hai-sheng, HONG Kai, HU Yue-hua. Use of Al2(SO4)3 and acidified water glass as mixture depressants in flotation separation of fluorite from calcite and celestite[J]. Minerals Engineering, 2019, 137: 160-170.
[20] 胡永平, 蔡殿忱. 盐化水玻璃在微细粒菱锰矿与伊利石等脉石矿物分离中的作用[J]. 中国锰业, 1991(5): 30-35.
HU Yong-ping, CAI Dian-chen. The role of saline water glass in the separation of fine-grained rhodochrosite from illite and other gangue minerals[J]. China's Manganese Industry, 1991(5): 30-35.
[21] 朱建光, 朱玉霜. 浮选药剂的化学原理[M]. 修订版. 长沙: 中南工业大学出版社, 1996: 324-328.
ZHU Jian-guang, ZHU Yu-shuang. Chemical principles of flotation agents[M]. Revised ed. Changsha: Central South University of Technology Press, 1996: 324-328.
[22] 谢晶曦, 常俊标, 王绪明. 红外光谱在有机化学和药物化学中的应用[M]. 北京: 科学出版社, 2001: 67-98.
XIE Jing-xi, CHANG Jun-biao, WANG Xu-ming. Application of infrared spectroscopy in organic chemistry and pharmaceutical chemistry[M]. Beijing: SciencePress, 2001: 67-98.
[23] 杨南如. 无机非金属材料测试方法[M]. 武汉: 武汉理工大学出版社, 2006: 145-156.
YANG Nan-ru. Test method for inorganic nonmetallic materials[M]. Wuhan: Wuhan University of Technology Press, 2006: 145-156.
[24] CHEN Xiao, NIU Zi-dong, WANG Jie, ZHU Guo-rui, ZHOU Ming-kai. Effect of sodium polyacrylate on mechanical properties and microstructure of metakaolin- based geopolymer with different SiO2/Al2O3 ratio[J]. Ceramics International, 2018, 44(15): 18173-18180.
[25] JI Xiao-fei, ZHOU Qian, QIU Gui-bo, PENG Ben, GUO Min, ZHANG Mei. Synthesis of an alumina enriched Al2O3-SiO2 aerogel: Reinforcement and ambient pressure drying[J]. Journal of Non-Crystalline Solids, 2017, 471: 160-168.
[26] 于 慧, 高宝玉, 岳钦艳, 王 艳. 红外光谱法研究聚硅氯化铝混凝剂的结构特征[J]. 山东大学学报(自然科学版), 1999, 34(2): 80-83.
YU Hui, GAO Bao-yu, YUE Qin-yan, WANG Yan. Study on the Structural characteristics of polyaluminum silicate chloride by infrared spectrum method[J]. Journal of Shandong University (Natural Science Edition), 1999, 34(2): 80-83.
[27] GAO Yue-sheng, GAO Zhi-yong, SUN Wei, YIN Zhi-gang, WANG Jian-jun, HU Yue-hua. Adsorption of a novel reagent scheme on scheelite and calcite causing an effective flotation separation[J]. Journal of Colloid and Interface Science, 2018, 512: 39-46.
[28] BAHRI Z, REZAI B, KOWSARI E. Evaluation of cupferron on the selective separation of gallium from aluminum by flotation: The separation mechanism[J]. Minerals Engineering, 2016, 98: 194-203.
[29] KAWALEC-PIETRENKO B, RYBARCZYK P. Al(Ⅲ) and Cu(Ⅱ) simultaneous foam separation: Physicochemical problems[J]. Chemical Papers, 2014, 68(7): 890-898.
[30] DENG Lan-qing, ZHAO Gang, ZHONG Hong, WANG Shuai, LIU Guang-yi. Investigation on the selectivity of N-((hydroxyamino)-alkyl) alkylamide surfactants for scheelite/calcite flotation separation[J]. Journal of Industrial and Engineering Chemistry, 2016, 33: 131-141.
[31] ZHANG Chen-hu, SUN Wei, HU Yue-hua, TANG Hong-hu, GAO Jian-de, YIN Zhi-gang, GUAN Qing-jun. Selective adsorption of tannic acid on calcite and implications for separation of fluorite minerals[J]. Journal of Colloid and Interface Science, 2018, 512: 55-63.
[32] ZHANG Jun-yao, ZHANG Li, KANG Le, MENG Yang-yang, ZHANG Ke. A new CaWO4/alkali-activated blast furnace slag-based cementitious composite for production of hydrogen[J]. International Journal of Hydrogen Energy, 2016, 42(6): 3690-3697.
[33] CAPECE A M, POLK J E, SHEPHERD J E. X-ray photoelectron spectroscopy study of BaWO4 and Ba2CaWO6[J]. Journal of Electron Spectroscopy and Related Phenomena, 2014,197: 102-105.
[34] MENG Qing-you, FENG Qi-ming, SHI Qing, OU Le-ming. Studies on interaction mechanism of fine wolframite with octyl hydroxamic acid[J]. Minerals Engineering, 2015,79: 133-138.
WEI Zhao1, 2, SUN Wei1, 2, HAN Hai-sheng1, 2, WANG Ruo-lin1, 2, LI Ai-min3, YANG Mei-qing3, HUANG Jing-hua3
(1. School of Minerals Processing and Bioengineering, Central South University, Changsha 410083, China;
2. Key Laboratory of Hunan Province for Clean and Efficient Utilization of Strategic Calcium-containing Mineral Resources, Central South University, Changsha 410083, China;
3. Ninghua Xingluokeng Tungsten Mining Co., Ltd., Ninghua 365400, China)
Abstract: The mechanism of selective inhibition of scheelite and calcite using Pb-BHA complexes and Al-Na2SiO3polymer self-assembled by Al3+ and colloidal silicic acid as collector and depressant was studied. The flotation results indicate that the separation of scheelite from calcite can be realized by Al-Na2SiO3. The infrared spectroscopy and solution chemical analysis results show that Al3+ and silicate acid form aluminosilicate polymer with Si—O—Al bond via chemical bonding. Zeta potential and XPS analysis results show that calcium cations of scheelite and calcite surfaces could bond to oxygen atoms of Al-Na2SiO3 through chemisorption, the calcium cations and oxygen atoms are the active site of the adsorption reaction. Compared with Na2SiO3, Al-Na2SiO3 shows less adsorption amount and weaker chemisorption on the scheelite surface, while the reverse is true on the calcite surface. The selective separation of scheelite from calcite is attributed to the cooperative selectivity of the Pb-BHA complexes and Al-Na2SiO3 polymer.
Key words: Al-Na2SiO3polymer depressant; Pb-BHA complexes collector; scheelite; flotation; sodium silicate
Foundation item: Project(2018CX036) supported by the Innovation Driven Plan of Central South University, China; Project(B14034) supported by the National Project 111, China; Projects(2018YFC1901601, 2018YFC1901602) supported by the National Key Scientific Research Project, China; Project supported by the Collaborative Innovation Center for Clean and Efficient Utilization of Strategic Metal Mineral Resources, China
Received date: 2020-05-15; Accepted date: 2020-11-11
Corresponding author: HAN Hai-sheng; Tel:+86-15111046402; E-mail: hanhai5086@csu.edu.cn
(编辑 龙怀中)
基金项目:中南大学创新驱动计划资助项目(2018CX036);高等学校学科创新引智计划资助项目(B14034);国家重点科研项目(2018YFC1901601,2018YFC1901602);战略金属矿产资源清洁高效利用协同创新中心项目
收稿日期:2020-05-15;修订日期:2020-11-11
通信作者:韩海生,副教授,博士;电话:15111046402;E-mail:hanhai5086@csu.edu.cn

